原文链接:https://mp.weixin.qq.com/s/nBgTgRqFcGtjJdmp_P37vw
paper: Neuromodulatory control of complex adaptive dynamics in the brain

神经系统微观组成的巨大维度和复杂性是如何受到足够严密的控制以协调适应性行为的?达到这种平衡的一个强有力的方法是使神经元接近相变的临界点,在这一点上,神经元兴奋性的微小变化可以表现出神经元活动的非线性增加。大脑如何调节这一关键转变是神经科学中一个关键的未决问题。在这里,我提出上行唤醒系统的不同分支为大脑提供了一组不同的异质控制参数,可以用来调节目标神经元的兴奋性和感受性——换句话说,充当调节关键神经元顺序的控制参数。通过一系列工作实例,我展示了神经调节唤醒系统如何与大脑中神经元子系统的内在拓扑复杂性相互作用,以调节复杂的适应行为。
1. 介绍
支配构成成人大脑的数十亿神经元相互作用的物理原理仍然知之甚少。任何具有如此庞大的一组相互作用的部分的系统都能够表现出非常复杂和异质的行为,这在很大程度上是由于该系统具有巨大的自由度。该系统的单个元素——即神经元和神经胶质——本身也是内在复杂和功能非线性的,这进一步增加了神经系统动力学的复杂性。也有强有力的证据表明,大脑包含无尺度的秩序——即跨多个空间和时间尺度进行组织。由于这些原因,难怪神经系统活动中出现的动力学高度复杂和灵活,但却是分布式和低维的。
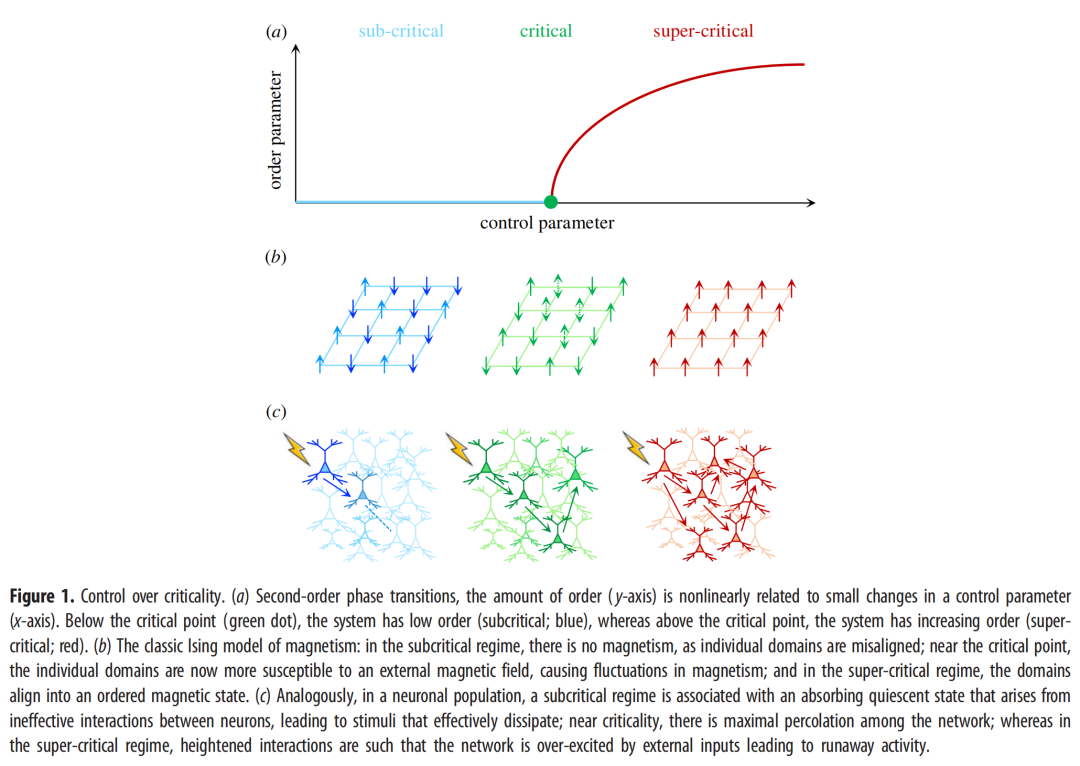
一个包含这些关键特征的框架是相变的临界点,相变出现在复杂系统中,表现为不同状态之间的突然转变(例如,有序和无序)[1,2]。处于(或接近)临界点的系统表现出许多与组织良好的神经系统相一致的有益特征。首先,处于临界点的活动是自我延续的,平衡于静止的静止和失控活动的繁盛混乱之间。第二,处于临界点的系统对多个数量级的输入变化敏感,并且它们能够在相似的大范围内组织对输入的响应。这种神经灵活性被认为形成了认知灵活但强健的运动计划的基础,旨在利用内部和外部影响[3,4]。最后,接近临界状态的系统也表现出发散的自相关性(这一过程被称为“临界减速”),这进一步使系统对各种不同的信号更加敏感。
在最近的几十年里,各种各样的方法被用来检测大脑中的临界信号。通过跟踪神经数据[3,5–9]中连续时间区间内动作电位(尖峰)活动或阈值局部场电位的分布,已经清楚地表明,神经群体通常遵循幂律分布特征,因此,在许多不同的记录技术中,观察到更大(波动/尖峰)和更长雪崩的概率相当大[2,6,10]。其他的方法着眼于时间活动,并使用去趋势波动分析[11,12],赫斯特指数[13,14]或功率谱[15]为神经记录中的临界性提供进一步的证据。使用不同的方法来评估神经动力学中的自相关性,导致了大脑可能实际上处于轻微的亚临界状态[16]的建议,这将赋予临界状态的好处,同时提供对系统中噪声波动的鲁棒性,否则可能会将临界系统推入危险的超临界状态。最后,对大脑皮层区域之间的结构连接的层次化、模块化组织如何将临界点“拉伸”到更广泛的准临界状态[17]进行了优雅的描述,进一步使系统对多种时空活动模式具有敏感性,同时防止进入超临界状态。总之,有一系列不同的方法,每一种都提供了大脑使用临界特征的补充证据。
尽管有大量证据表明大脑中存在临界状态,但寻找促进临界转换的生物机制(称为控制参数)仍然更具挑战性。在这里,我提出了一个论点,即上行环系统(AAS)——一组连接脑干、丘脑、下丘脑和基底神经节与大脑皮质的皮质下结构——是控制关键大脑动力学的一种似乎合理的方法。通过调节目标神经元的兴奋性和感受性,AAS能够转移分布式神经活动,以最大化紧急动态的适应能力,同时赋予大脑灵活性、鲁棒性和效率。在这篇手稿中,我将首先概述AAS的基本原理,并提供证据表明它们在调节大脑临界状态中的作用。然后,我将通过强调唤醒系统的不同分支的特质特征作为不同的控制参数来阐述这一观点,这些控制参数以有助于解释大脑中不同神经化学途径的功能特征的方式进一步增加和分布临界状态的特征。通过这种方式,我希望在神经生物学、系统神经科学和统计物理学之间架起一座统一的桥梁。
2. 一个复杂的适应性系统,受上升唤醒系统的控制
在动态系统中,控制参数是调节相变的系统属性,通常会影响系统组件的状态或顺序。一个经典的例子来自磁的伊辛Ising模型(图1b)——在这里,温度是一个控制参数,调节铁磁材料的出现磁场强度。如果温度很高,铁磁体是非磁性的——由于随机的热波动,所有单个磁畴都以随机的方向取向,导致缺乏全局有序性(因此没有磁性)。在较冷的温度下,单个磁畴的波动减少,因此,磁体保持锁定在高度有序(因此,磁性)的状态。在临界温度下,一个介于这两个极端之间的值,磁畴在多个尺度上是协调的——即在内部的磁岛中存在磁岛(等等)。至关重要的是,在临界点,磁体最容易受到外部磁场的影响——即施加的磁场可以快速穿过磁体排列畴。在大脑中,关键过程通常表现为一连串的尖峰信号,这些尖峰信号要么消散(亚临界),要么表现出失控的活动(超临界),要么位于一个区域,在该区域中它们可以自我延续以促进交流(图1c)。
一个控制参数必须具备什么特征才能模仿大脑中的这些特征?首先,与伊辛模型中的温度一样,控制参数应该对系统的大部分具有(相对)全局影响——信号覆盖范围越大,系统就越有可能对控制参数的变化做出一致反应。其次,负责实例化系统范围控制的神经系统相对于受控群体应该是相对低维的,这样信号可以传播到分布在系统中的多个不同区域[18,19]。最后,控制参数应保留改变系统单个元件敏感性的能力。在铁磁材料的情况下,磁体磁化率的增加是由空间分离的磁畴之间的发散相关长度来调节的。有了这些简单的特性,控制参数(在临界点)的细微变化会对系统的顺序(以及磁性)产生很大的影响。关键问题就变成了——我们在大脑的什么地方看到了这些特征的证据?
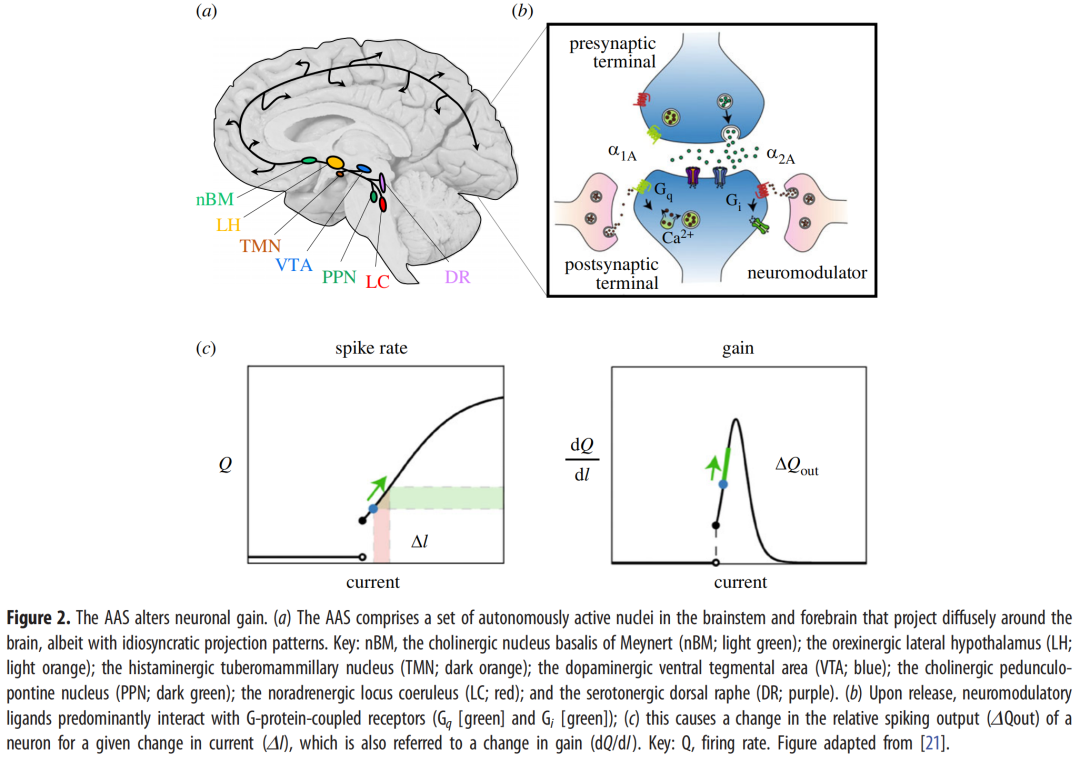
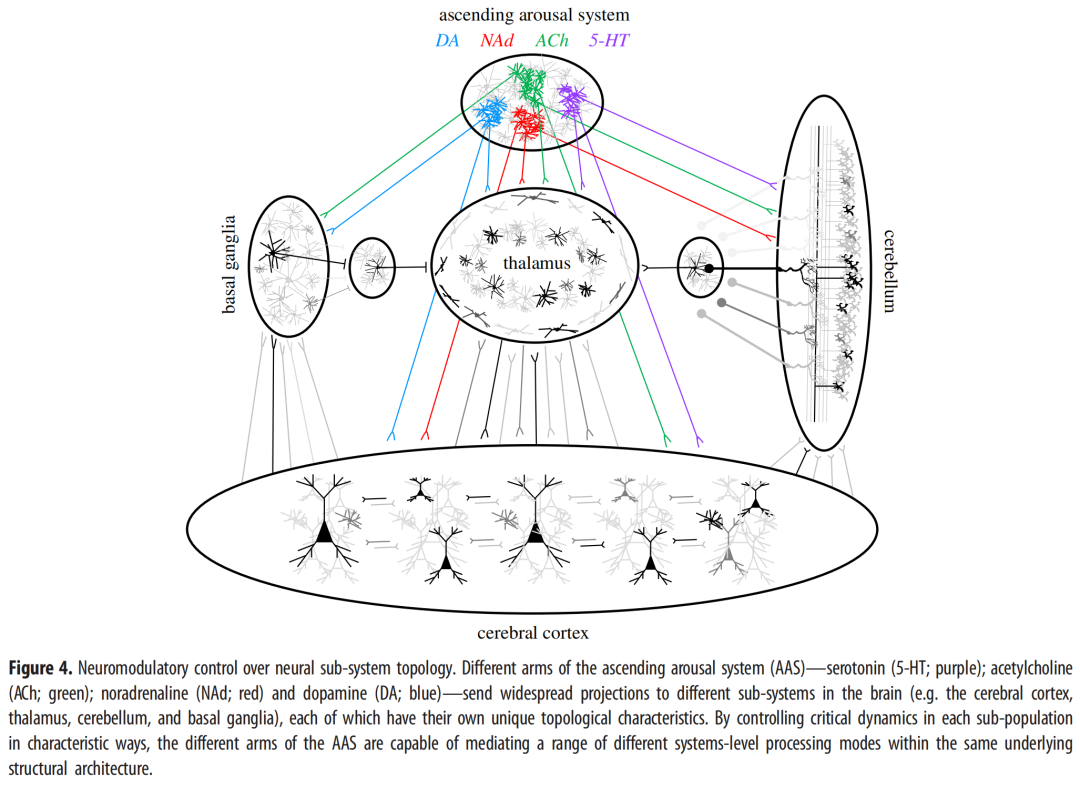
虽然大脑中有许多区域共享这些特征中的一些(但不是全部),例如弥散投射的基质丘脑核[20],但有一个系统排列得非常好——即,上升觉醒系统(AAS图2)。AAS是脑干和前脑中高度保守的细胞核的集合,它们在觉醒(和各种睡眠状态)期间自主活动,将无髓鞘轴突广泛发送到整个大脑,包含的神经元数量明显少于其投射目标,并改变传出目标区域中神经元和神经胶质的兴奋性(以及敏感性)[21–24]。如上所述,这些特征与像大脑这样的复杂动力系统的有效控制参数的要求精确一致。与生物系统的情况一样,AAS改变磁化率的具体机制非常有助于了解它们在大脑中的计算作用。因此,我将概述这些特征,并(在可能的情况下)通过经验和理论研究将AAS的元素与它们的计算签名联系起来。
在苏醒期间,组成AAS的神经元以相对恒定的速率产生尖峰信号[23–25]。这种普遍的紧张性尖峰实际上是一个众所周知的特征,它将清醒的大脑与深度睡眠阶段的同一系统区分开(即from[23,26])、麻醉[13,26,27]和昏迷[28]。有趣的是,对AAS内不同区域的电刺激可以唤醒被麻醉的动物[29,30]。鉴于这些相同的过程可以通过模拟AAS的影响来模拟,这就为大脑中唤醒系统介导的关键过程提供了证据。重要的是,中间活动模式也与特定的功能信号有关——例如,执行复杂认知任务的能力与前额皮质中神经调节剂去甲肾上腺素的中间水平有关[31,32]。就去甲肾上腺素而言,去甲肾上腺素水平之间的倒U型关系(即唤醒)和认知功能被称为耶基斯-多德森关系[33]。
构成AAS的大多数细胞核相对弥散地投射到整个大脑。去甲肾上腺素能蓝斑核、5-羟色胺能中缝背核和组胺能结节乳头核是最分散的[24,34-36],而多巴胺能黑质/腹侧被盖区[37]和胆碱能基底核、脚桥核/背外侧被盖和内侧隔[38,39]以更有针对性、分离的方式投射。通过这些广泛的接触,神经调节核的局部活动可以分布在大脑的大部分区域,从而允许整个神经系统做出相对低维的协调反应[21,40,41]。与磁体的例子非常相似,神经调节张力的微小变化,特别是当它们迅速发生时(即,在阶段性爆发中),可以在整个大脑中产生广泛的变化,模拟关键系统的已知特征。
当受到刺激时,AAS的轴突纤维从其末端纤维中储存的小泡中释放神经调节配体。这些配体被释放到突触或细胞外空间,在那里与跨膜G蛋白偶联受体相互作用。这些受体反过来以改变目标区域兴奋性(或增益)的方式对神经元和神经胶质内部环境进行主要的顺应变化[21]。不同的神经调节系统使用两种主要类型的神经调节受体[42]:高亲和力Gs/i受体,其改变目标神经元的不应期和静息电位;和低亲和力Gq受体,其从内部储备中释放细胞内Ca2+离子,并因此使细胞的膜电位更接近其反转电位(因此增加了可能性动作电位形成)。根据受体的密度、它们在神经元上的精确位置(即突触前或突触后)以及它们所在细胞的特性(即兴奋性或抑制性神经元),这些通路的激活(或沉默)可以对紧急活动模式产生实质性影响。
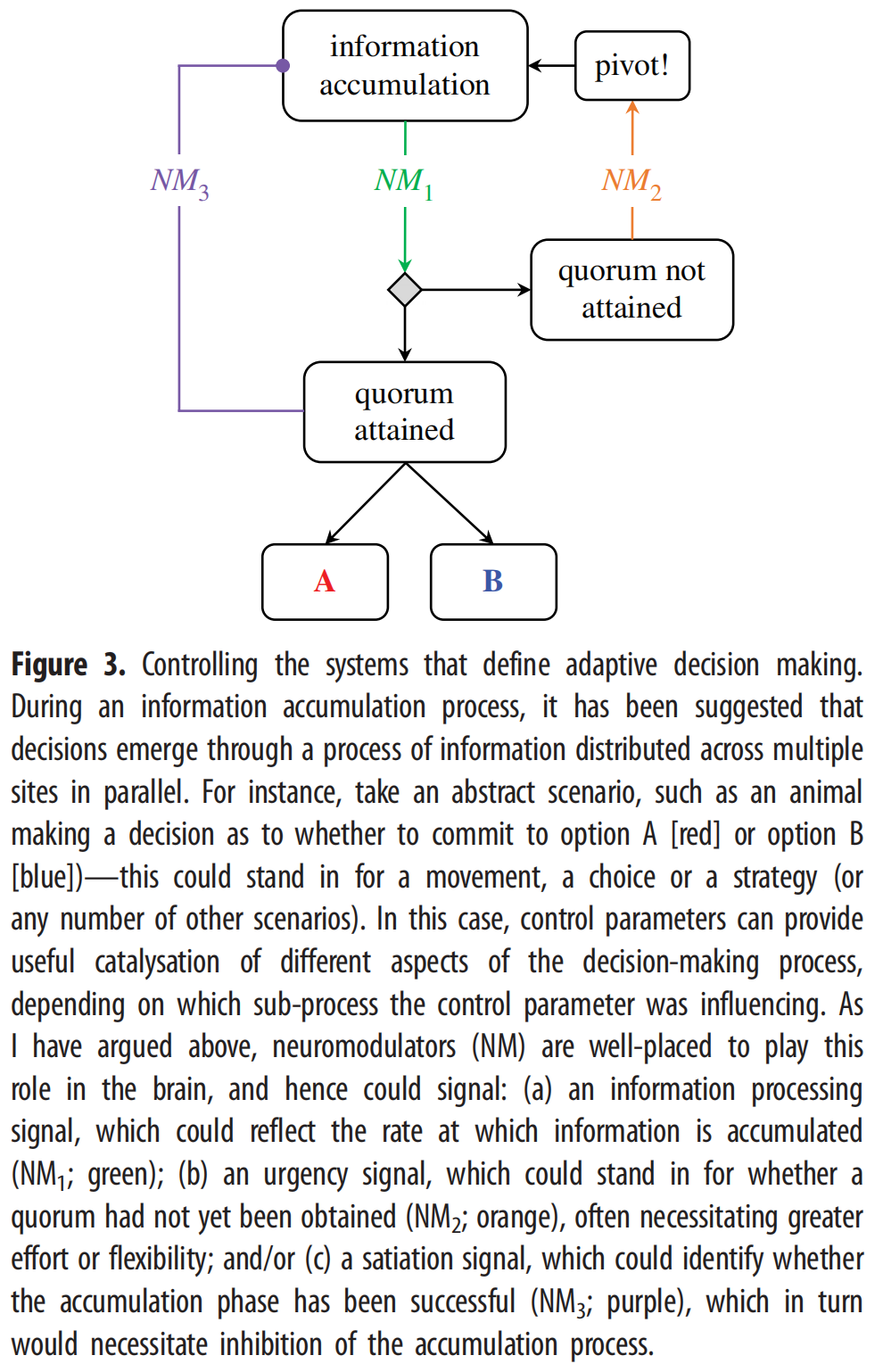
通过改变兴奋性和抑制性神经元的增益,神经调节配体可以作为特定神经亚群的控制参数,进而改变它们处理信息的方式。从这个角度来考虑唤醒系统,对决策的系统层面的理解有着特殊的意义。那么,在分布于大脑各处的神经元群体中,这一过程会如何进行呢?一个正在形成的共识将大脑中的决策描述为并行分布在多个位置的信息积累[43,44]。在这个框架内,决策反映了神经“quora”的存在(图3),每个信号代表一个特定的选项,如结果、行动计划或特定特征的存在(或不存在)。虽然这一过程的微妙之处仍在研究中,但生物学中有许多分布式决策过程的例子,可以为相同的过程如何在人脑中发挥作用提供直觉[45]。例如,细菌使用化学信号来跟踪群体决策[46],蚂蚁[47]和蜜蜂[48]似乎都依赖于积极的反馈模式来确定移动到新地点的适当时间以及移动的方向。在每一种情况下,跟踪quora形成能力的一个关键变量是个人存储的信息量和群体共享的信息量之间的平衡(图3;[49]).
重要的是,个体之间隔离的信息存储和共享的信息传递之间的平衡正是由AAS的神经调节配体调节的变量。事实上,来自计算模型的证据表明,神经调节系统的增益改变机制可以精确地促进这种信息传递[50],其中神经增益的变化可以改变宏观大脑网络拓扑结构的系统水平,如通过fMRI等技术测量的[40,41]。这些计算联系使我们预测,在认知加工过程中,低水平的神经肌肉紧张度将介导一种自我支配的模式,这种模式与相对较高的局部信息存储有关[50]和一个隔离的网络结构[40,41],而在较高水平的神经调节张力下,区域间反馈的增强将导致信息传递的增加[50]和一个更加一体化的网络拓扑[40,41]。虽然没有通过AAS的镜头进行询问,但有证据表明,这种群体形成框架提供了一种在两种选择的强迫选择中皮质活动的简约描述[51]。
AAS的这些特征都与它们在大脑中作为控制参数的作用相一致。通过增加(或减少)通过谷氨酸介导的动作电位序列传播的信号[52],AAS被理想地放置在塑造整个大脑的关键动态的位置。但如果情况确实如此,人们会想知道为什么大脑会保留这么多不同类别的神经调节化学物质来发挥作用,这些化学物质可以通过,比如说,大脑不同区域中更细微的受体分布图有差异地接收的单一控制参数来维持。
我们在大脑中观察到的神经调节控制多样性的一个假定好处是,它可以允许系统根据动物的给定需求转变为不同的处理模式[53-55]。保留多个控制参数的另一个(非相互排斥的)好处是,不同的神经调节核可以补充(因此,增加或减少)表征大脑不同区域的独特连接结构中固有的拓扑特征[55,56](图4)。尽管大脑中有数十亿个神经元,但它们之间的连接方式却因神经元的位置不同而有显著差异。这种差异最引人注目的莫过于大脑皮层组织内部固有的差异(大脑皮层被认为是松散地组织成以特定方式相互连接的细胞列;[57,58];图4)和小脑(这是有组织的模块化结构的典型例子,具有在整个小脑覆盖层重复的精确细胞基序;[59];图4)。考虑到不同的计算益处被认为来自这些不同拓扑组织的机制[55,56],任何可以增加其中一个或另一个的神经调节化学物质因此可以代表在神经系统中产生差异的差异。
3. 塑造丘脑的信噪比特性
神经调节性神经递质在丘脑形成进化活动模式中起着至关重要的作用。特别是乙酰胆碱和去甲肾上腺素的添加[60,61]已经显示出将丘脑从相对稀疏的“突发”模式(通常在慢波睡眠和静息时升高)转变为更活跃的“紧张”模式(其往往在清醒时更频繁地发生[62];虽然见[63])。相比之下,这两种神经调质对网状核也有相反的作用:乙酰胆碱超极化,而去甲肾上腺素去极化抑制核[60]。这些效应的系统水平影响提出了有趣的难题:尽管去甲肾上腺素能状态下信噪比的提高[64]与我们在相对警惕状态下感觉辨别能力的增强[65]相一致,但胆碱能调节丘脑中的噪声背景信号更难以与通常归因于胆碱能状态的聚焦、正常化[66]和稳定的脑状态轨迹[22,67]相统一。一个有趣的可能性(有待经验证实)是,胆碱能对神经元变异性的调节的极端情况仅出现在纯胆碱能状态(如快速眼动睡眠;[68]),但在清醒状态下被其他活跃的神经调节系统(如去甲肾上腺素能、5-羟色胺能和多巴胺能系统)抑制。
与去甲肾上腺素和乙酰胆碱相比,丘脑中血清素的主要作用是超极化丘脑中继核,从而抑制紧张性放电模式[69]。有趣的是,超极化反应的幅度通常在弥散投射的高阶核中更明显[69]。因此,丘脑血清素增加的效应可能使系统偏向确定性的,通过减少反馈过程在整体大脑状态的动态进化中的作用的前馈处理模式。灵长类丘脑的联合核也接收大量多巴胺能输入[70],尽管这些投射的确切作用目前知之甚少[71,72]。鉴于丘脑和皮层之间的重要相互作用,这为兴奋和抑制之间的平衡提供了重要的约束[73],并塑造了动物对周围世界的意识[74-76],我认为神经调节输入以直接影响大脑皮层活动的临界传播的方式调节丘脑的兴奋性(图1c)。


4. 大脑皮层中前馈和反馈模式之间的转换
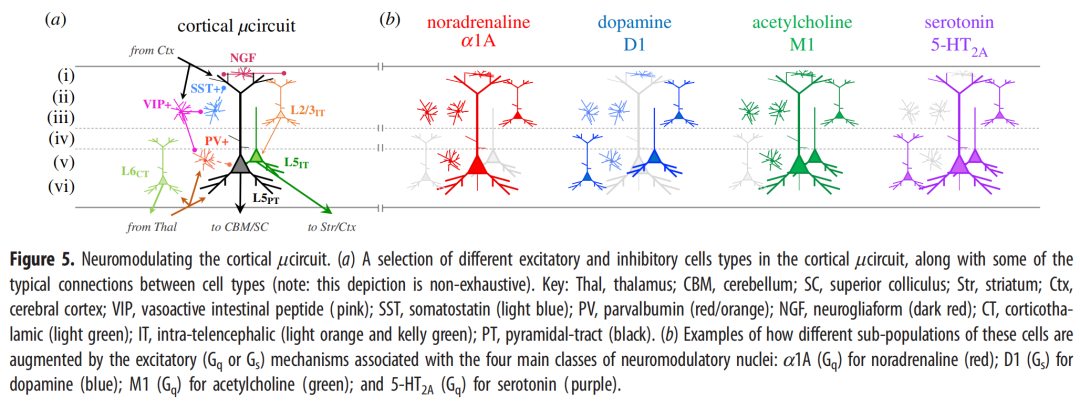
大脑皮层内兴奋性和抑制性细胞的巨大多样性和异质性使其能够以许多不同的模式进行处理,这些模式又受到不同神经化学物质的调节。例如,从丘脑到皮层的输入(图5;深红色;[20])或更低(更颗粒化)的皮层区域[77,78]可以导致皮层区域内的锥体细胞发送稀疏的棘波,并因此以相对确定的前馈模式起作用。相比之下,反馈投射来自皮质层级中较高的区域[77],并投射到较低皮质区域的超颗粒层,其中它们支配神经元间和锥体神经元的顶树突以及L2、L3和L5中的细胞体(图5)。这两种活动流被认为结合在一起,在大脑中形成了一种预测处理,尽管不同的实施水平的预测取决于被研究的特定细胞[79-81]。例如,预测处理的一个提出的实现建议,当前馈和反馈信号在精确(大约)范围内一致时。30 ms)颞窗,有证据表明厚簇状的第5层锥体束细胞(L5PT图5;灰色)经历“顶端放大”并过渡到NMDA受体介导的爆发模式,这极大地增加了它们的信噪比属性[82],以某种方式将它们的活动整合到有意识意识的进化状态中[56,79,83]。
有证据表明,胆碱能系统可能有利于前馈处理模式[84],通过刺激端脑内(IT)锥体细胞[85]或招募小清蛋白染色的快速尖峰GABA能中间神经元[86,87],利用前馈抑制[88,89]促进皮层中的高频伽马节律[90]。这些神经生物学的细节可能有助于解释大脑中胆碱能张力和集中注意力的主要计算账户之间的联系——即分裂标准化[66]。其他神经调节课程反而可以促进反馈处理的增加。有证据表明,神经调节神经递质可以直接促进顶端和基底树突树L5PT锥体细胞之间的相互作用[91–94]。超极化激活的环核苷酸门控(HCN) Ih通道通常确保L5PT的顶端和基底树突区室保持彼此电隔离[82,95,96]。重要的是,去甲肾上腺素通过激活α2A抑制这些通道受体[31,93],与前额叶皮层中已知(有些矛盾地)增强认知功能的受体相同[32,97]。这是如何工作的?当HCN通道被阻断时,静息漏电流在L2、L3和L5锥体细胞的顶树突内逆转,使得来自大脑皮层的较高区域的充满上下文的反馈信号能够暂时与来自颗粒层以下的信息流的前馈通道一致(可能通过L2/3IT锥体细胞的广泛水平投射)与L6细胞接触[98]),并将该细胞转变为突发放电模式[99]。最近,小鼠躯体感觉皮层中L5PT锥体细胞的顶端扩增与阈上知觉发作[100]有关,并区分了清醒和麻醉[94],这表明这种机制可能对调节我们的意识至关重要。
其他种类的神经调节递质也可以影响大脑皮层中的信息流,特别是当它们对大脑中独特的细胞种类产生不同的影响时。这对于抑制性中间神经元尤其如此对许多认知、运动和注意力能力非常重要[101–103]。例如,VIP+中间神经元[89,101]的去抑制能力,其专门突触到其他(主要是SST+)中间神经元[105]上,因此去抑制[104],受到血清素和乙酰胆碱[106,107]的快速离子性影响,以及去甲肾上腺素和乙酰胆碱的缓慢代谢性影响(图5b)。离化效应的快速时间尺度(微秒级)意味着这些细胞可以以高时间精度将金字塔细胞从前馈模式转变为反馈模式[102]。这可能有助于解释为什么小鼠桶形皮质中的VIP+中间神经元对胡须的有意运动[103]和活跃、清醒的行为[108]至关重要,这可能是通过增强伽马带相干性[109]实现的。相比之下,晚期尖峰神经胶质细胞[110](图5a;红色)主要受代谢型神经调节控制[107],这表明它们在大脑皮层内的晚期超极化效应仅在相对较慢的时间范围内受到调节[105]。远不限于这些具体的例子,我们可以预计,未来几年将带来神经调节和中间神经元募集之间关系的更精细的评价[90,111],特别是考虑到抑制性稳定对于介导大脑皮层有效计算的重要性[112–114]。
大脑皮层中不同神经递质受体家族的层状地形图也非常重要[115–117]。在最近使用定量体外受体放射自显影术以微米分辨率扫描死后人脑的工作中,已经表明抑制性5HT1受体,已知其促进冲动和目标导向行为之间的平衡[118],主要表达于穿过皮质套的超颗粒层[115]。同样,促进锥体细胞爆发的α2肾上腺素能受体[31,93]选择性地富集在前额叶皮层的超颗粒层[115]。相比之下,烟碱胆碱能受体通常富集在颗粒层,特别是初级感觉皮层[115,119]。烟碱受体的激活已被证明抑制it型和PT型,同时激活小鼠额叶皮质中的CT型pyr-酰胺细胞[120,121]。这些机制表明,大脑皮层中去甲肾上腺素、血清素和乙酰胆碱(以及其他物质)之间的平衡对全脑功能动力学[122]产生了重要的限制,从而可以改变皮质丘脑回路内的临界动力学,以调节大脑中的适应性信息处理模式。
5 多巴胺对皮质纹状体回路的分布式影响
神经调节投射的扩散性质意味着神经调节配体的作用是由它们的多个串联回路产生的,然而,许多现有的文献(有充分的理由)一次只关注一个区域。也许这方面的典型例子是神经化学物质多巴胺。有大量文献将基底神经节的功能与来自黑质致密部轴突的神经化学物质多巴胺[123]的相对水平联系起来。流行的观点是多巴胺的作用是兴奋Gs介导的D1受体纹状体中的“直接”通路(其具有释放苍白球内侧的紧张性抑制作用的效果)并抑制“间接”通路的胃肠介导的D2受体(其具有相反的效果)。总之,这两种途径之间的平衡被认为在行为的准备和选择中起着重要作用[124],precise功能取决于哪个皮层和丘脑区域支配该结构。
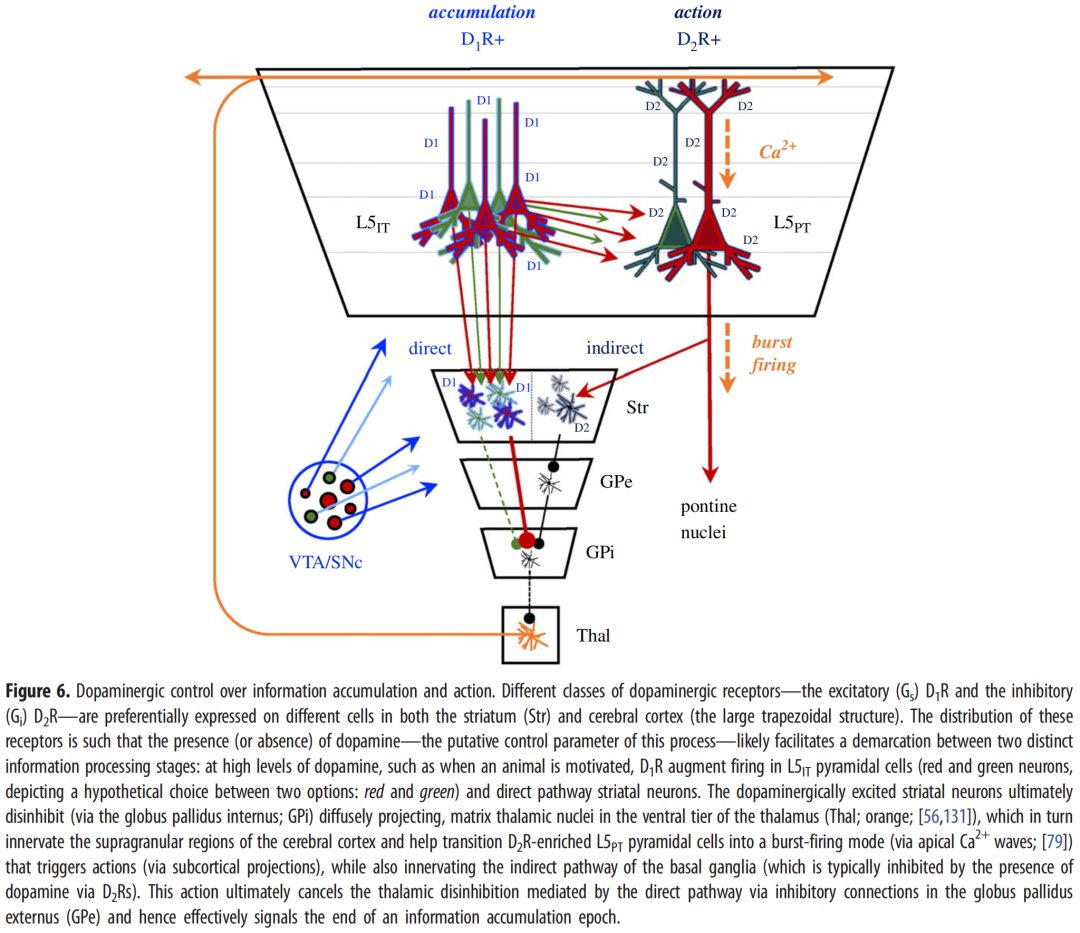
不太清楚的是,这些多巴胺敏感系统还与大脑皮层中与多巴胺能紧张度不同相关的精确回路相互连接。具体来说,有证据表明端脑内(L5IT图5a中的深绿色)在第5层中具有细胞体的细胞主要表达兴奋性D1受体[125],并投射到纹状体中表达D1的直接通路多刺投射神经元[126],而锥体束(PT型[L5PT];图5中灰色)表达抑制性D2受体[127]并投射到表达D2的间接途径纹状体神经元[126]。重要的是,这两种细胞群在行动计划(L5IT)和执行(L5PT)中的参与程度不同[128–130]。这表明从中央被盖区和黑质致密部释放的多巴胺不仅影响纹状体的临界动力学,还影响投射到这些通路的大脑皮层中的分布式兴奋性群体。
这些分布式回路有助于解释多巴-胺在行为选择中的作用(图6)。当有一个动作要选择时,多巴胺的存在(或缺乏)将刺激L5IT细胞群(例如红色对绿色),然后它们相互竞争优势。这种竞争被认为是通过向L5IT发送动作电位的回路发生的,而L5IT又因多巴-胺的存在而增强(即它们表达兴奋性D1Rs)。这些相同的L5IT细胞支配纹状体的直接通路(图6中的富含D1R的细胞),该回路的激活导致弥漫性投射基质丘脑细胞的去抑制,这些细胞向大脑皮层的颗粒上层发送弥漫性折返投射[56,131]。这些丘脑投射(图6;橙色)正是那些负责将L5PT细胞转变为触发动作(在这种情况下,选择“红色”或“绿色”)的爆发放电模式(见上文)的细胞,部分通过在丘、丘脑、脑桥核(因此,小脑)和脊髓中招募细胞[56,79,132]。通过激活间接途径(即表达D2R的细胞),L5PT细胞被理想地置于“关闭”纹状体的位置,无论何时决定采取行动(即当达成共识时)。这种机制与动物执行动作时纹状体降低其放电频率的事实相一致[133]。
这如何与其他神经调节系统保持一致?乙酰胆碱对基底神经节的处理模式也有重要影响[134,135]。与多巴胺相比,胆碱能输入实际上在“间接”途径中更加丰富,这通常与丘脑和脑干靶的GABA能抑制有关。胆碱能配体还可增加纹状体中胆碱能中间神经元的活性,从而抑制直接通路[135]。这表明,特定回路促进或抑制向皮质颗粒上区域扩散投射的基质丘脑投射的能力取决于多巴胺和乙酰胆碱之间的平衡,而不是单独的任一神经递质的绝对浓度。同样重要的是要注意到纹状体(基底神经节的主要输入核)中主要的γ-氨基丁酸能中间神经元种类之一也富含胆碱能受体[134]。总之,这些事实对于理解胆碱能功能和选择性注意力之间已知关系的生物学基础具有重要意义,这可能与大脑皮层[86,87]、丘脑[85]以及基底神经节的间接途径[135]中的胆碱能机制有关。考虑血清素对基底神经节的复杂、非线性影响也是有趣的[136],特别是考虑到血清素能中缝背和胆碱能系统之间的强相互联系[137],以及血清素在促进大脑中不同信息处理模式方面的作用,我接下来将谈到这一点。
6. 切换小脑和大脑皮层之间的活动平衡
虽然对基底神经节中不同神经调节化学物质的作用了解很多,但对小脑调节的影响了解较少[138]。然而,有证据表明扩展小脑回路中的不同区域实质上由血清素调节[139]。例如,脑桥核[140]、下橄榄核[141]和小脑皮质[139]在血清素存在的情况下都会增加它们的兴奋性,并将这些核中的许多转移到相对高频的放电模式[139]。此外,已知血清素可增强小脑皮质中Lugaro中间神经元的兴奋性[142],其作用类似于皮质VIP+中间神经元,并抑制其他小脑中间神经元。如同在皮质中一样,这些细胞的激活具有解除小脑颗粒细胞抑制的作用。结合抑制性(Gi/o)5-ht1r在皮质锥体细胞的轴突初始段中高度表达的已知事实,血清素可能用于切换小脑和大脑皮质之间的活动平衡,尽管可能呈倒U形关系[143]:相对低水平的血清素可能抑制大脑皮质并募集小脑,而较高水平的血清素可能募集VIP+中间神经元(通过5-HT3R)和PT-型锥体细胞(通过5-HT2AR) [144,145]。胆碱能系统对小脑功能也有重要影响[146]。例如,乙酰胆碱给药增加了与脑桥核(小脑的两个输入结构之一)接触的皮质锥体细胞的放电频率[147]。此外,还有证据表明小脑皮质的颗粒细胞层[148]是人脑中数量最多的细胞群[149],小脑的主要输出物小脑深部核[150]都受到胆碱能张力增加的刺激。这些过程绝不是对特定神经递质的选择性[151],但它们确实表明,升高的血清素和乙酰胆碱对小脑塑造核心丘脑活动的影响具有优先影响,因此对大脑皮层内的前馈活动模式具有优先影响。
7. 复杂适应动态的临界调制
这些过程如何在大脑中复杂的单个子回路中展开,每个子回路都可能通过神经调节配体的不同组合增加(减少)(图3)?构建这些想法的一种简洁方式是在吸引子景观landscape框架的上下文中,其中基于状态的神经动力学被构建为穿过吸引子景观的轨迹,该吸引子景观landscape的拓扑由行动机会(即,启示;[55,56,152]).在吸引子景观landscape框架内,可以认为神经调制器操纵吸引子景观的地形[22,153]。例如,添加乙酰胆碱已被证明可强化地形(即,可能通过颗粒层[154]的离化增加,使地形更崎岖,井更深[67])。相比之下,去甲肾上腺素和血清素的添加将导致景观的平坦化(即,这相当于整合大脑[22,40,41,153],可能通过招募超颗粒反馈连接)。这将具有“重置”网络景观的效果[22,155],允许大脑到达被景观地形隐藏的状态。其他人认为,高水平的血清素,特别是当配体激动5-HT2A受体时,可以导致类似的能量景观landscape变平[156]。这样,响应于感觉、认知或情感事件的神经调节性神经递质的释放将促进大脑的动态重组,从而使适应性行为最大化。虽然仍处于萌芽阶段,但我设想用动力系统的语言概述神经生物学逻辑组织的框架是理解神经系统多尺度适应性动力学的基础语言的重要支柱之一。
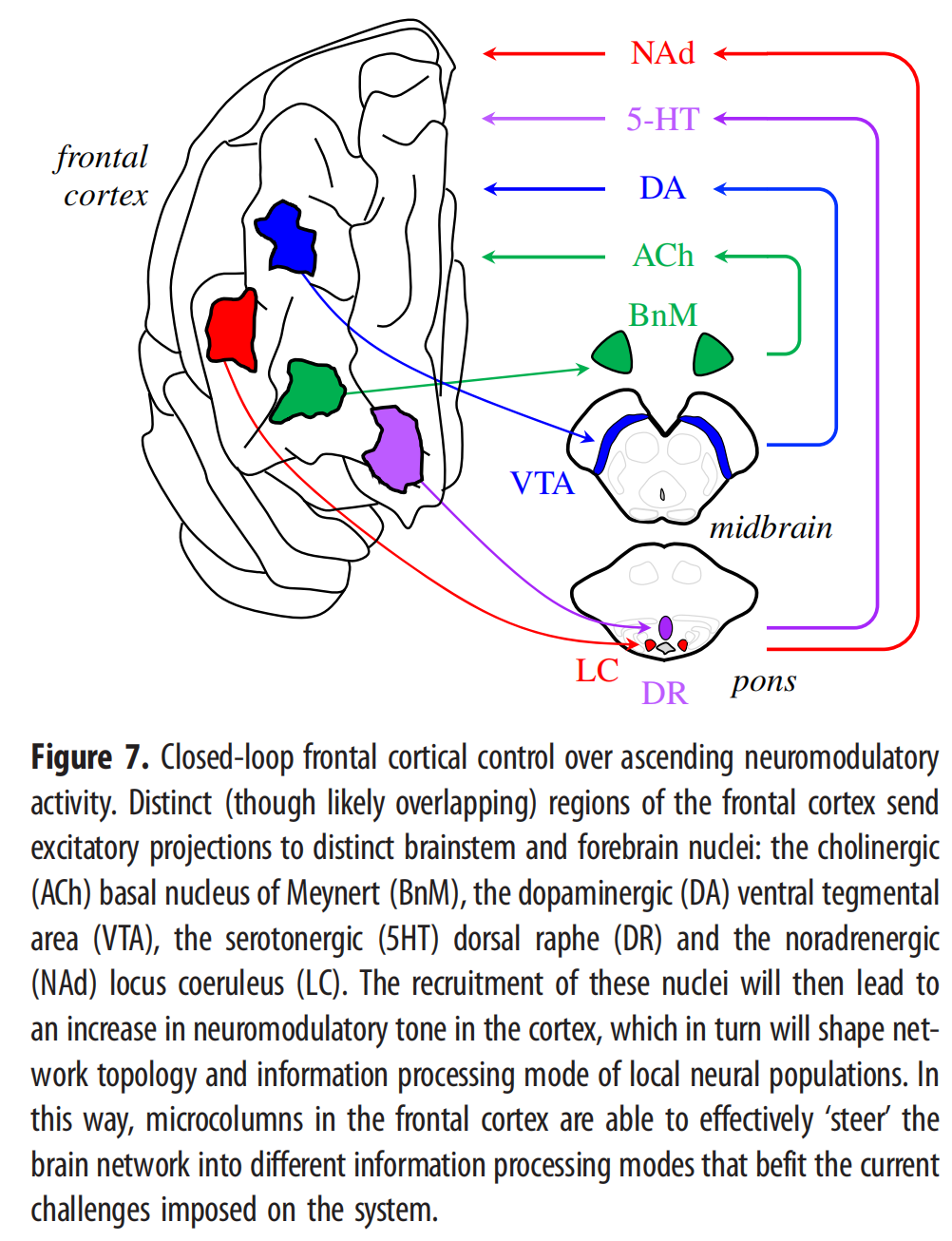
从这个角度来看,一个关键问题变成了神经系统如何控制其神经调节控制系统?整个AAS进一步受到下丘脑[157]和更多腹侧整合区域(如在脑干中共同形成异源树突核心的巨大细胞)中的主控制器神经元的神经调节影响。许多其他皮质下结构能够兴奋和抑制AAS的投射核[159],通常是通过靶向在投射核周围区域占优势的GABA能神经元[53,160]。这些近AAS细胞也接收来自L5PT锥体细胞子集的大量输入[159,161]。通过这些联系,大脑皮层保留了对神经运动核活动的闭环控制,这反过来又可以调整到特定的认知场景,如不确定性[162]或贝叶斯惊讶[163,164]。重要的是,增加活动的影响在这些细胞核内,可能对大脑中的网络拓扑[22,40]和信息处理[50]有重要影响。此外,额叶皮质中的不同位置已被证明投射到脑干中的独特核团,这表明对大脑中上行神经调节张力的细微控制(图6)。事实上,已经表明,控制大脑状态的时间演变的能力与大脑周围的神经递质受体分布的异质模式有关[122,165],允许对神经调节化学物质的闭环控制来控制大脑状态在假设的吸引子景观周围的流动[55,56,152,166]。有趣的是,许多神经调节核的皮质投射也大量支配AAS中枢附近的局部抑制性(即GABA能)结构[159,167,168],这表明下行投射的一个关键特征可能是控制局部神经调节中枢的兴奋性/抑制性平衡(图7)。
通过这个镜头,智人外侧额叶皮质的相对进化扩展呈现出一个有趣的新视角。通过增加从额叶皮质到脑干和前脑唤醒核的下行连接,人脑可能极大地增加了控制机制的维度,该控制机制用于塑造吸引子景观的地形。这将为人类大脑提供更大的灵活性,以便在我们所处的复杂的社会文化景观中找到不同的局部最小值。打个比方,在现代航空公司的驾驶舱里飞行,有无数的控制器和仪表,而莱特兄弟只有有限的控制器。这种对状态空间动力学的细粒度控制表明,在多个层次上平衡探索和开发的竞争性权衡的能力有所提高,这反过来可能有助于解释已知表征人类行为的微妙认知架构。
8. 结论
这些年来,已经有许多令人信服的、关于高级大脑功能的推测,试图根据大脑的紧急功能来描述大脑。例如,人类的许多认知可以成功地概念化为“好像”一个理想化的贝叶斯模型中出现的行为[171]。其他人认为,认知功能的系列模型背叛了从生物科学发展而来的直觉,相反,我们更高的神经能力在某种程度上来自各种自主主体活动的动态协同[172–174]。然而,尽管这些方法已经产生了很大的影响,但将计算账户与在神经生物学强加的框架内工作的过程模型联系起来仍然具有挑战性。事实上,生物学强加的概念限制往往比大脑的计算账户强加的限制更加严格。简而言之,神经元和神经胶质的精确互连限制了它们组织的灵活性,从而限制了高级大脑功能从大脑中出现的方式。
我们的全脑功能工作模型的一个主要限制是对大脑如何在多个不同的空间和时间尺度上组织的认识不足。本质上,我们知道中枢神经系统的组成部分已经有一段时间了,但我们缺乏对不同部分相互连接和相互作用的方式的真正理解。许多研究项目专注于大脑中的特定位置(举个流行的例子,如视觉皮层),并试图了解该特定回路的功能。这个想法是详细理解系统的子组件,然后将不同的单元组合在一起,努力理解系统的整体。无论从哪方面来看,这种方法都非常成功。然而,我们也知道,大脑中的单个回路不会自行进化,而是嵌入到中枢神经系统其他许多不同元素的更广泛背景中[175]。例如,现在有充分的证据表明,复杂的行为,如工作记忆[176,177]和决策[43,178],不仅涉及大脑皮层,还涉及广泛分布于中枢神经系统的回路,如丘脑、基底神经节、小脑、丘和脑干[55,56]。此外,子组件之间的许多连接是高度精确、保守的,并且对系统范围的功能至关重要。
最近的大规模、多中心研究,如艾伦大脑图谱[179]、BlueBrain [180]和人类连接图项目[181],改变了现代神经科学研究的进行方式。这些方法提供了神经架构的蓝图,具有细胞类型及其连接的高分辨率全脑地图[182],以及微观细胞复杂性的详细重建[180,183]。这些数据一起揭示了细胞构成中复杂的空间模式和大脑微电路的组织。在宏观水平[122,184]上也观察到了类似的模式,这表明了介于两个极端之间的中观组织水平的潜力。然而,为了真正理解这些系统的涌现动态如何产生认知[185],我们需要完善我们对中枢神经系统的不同子组件如何在系统水平上协同工作的理解。在这一领域取得的进展无疑将有助于我们更好地了解控制神经系统疾病的因素,如痴呆,这与AAS中关键结构的病理损伤有关[186,187],精神疾病,这通常通过AAS的操作来治疗[188],以及癫痫等疾病,这在过去与超临界动态疗法中的神经活动有关[189]。
在这篇手稿中,试图勾勒出一种方法的开端,这种方法从神经生物学的关键特征开始,然后旨在确定这些实施层面的细节可能会对构成人类大脑的数十亿个细胞中出现的神经活动的大规模动态模式产生什么(如果有的话)计算上的好处。具体来说,我认为AAS被认为是一组不同的控制参数,用于调节大脑中的临界动力学,唤醒系统的异质性反过来增强了成熟神经系统特有回路的临界能力并使其多样化。具体而言,在大脑中存在其他(相对)扩散投射系统,如丘脑矩阵核[20,55,56,153,190],它们可以提供对临界动力学的类似类型的控制,尽管在更快的时间尺度上(由于它们的主要谷氨酸能信号)和在空间广泛的域上(由于它们更有针对性的投射模式)。随着我们对大脑的详细神经生物学和元素相互作用的方式有了更多的了解,我想这幅图只会在复杂性和细微差别方面得到欣赏。例如,虽然我在这篇手稿中没有涉及它们,但在AAS和非神经元神经胶质细胞(如星形胶质细胞)之间存在至关重要的相互作用,这对能量代谢非常重要[191,192]。如果我们能够利用全脑建模[153,193,194]和神经成像[22,122,195–197]方法继续发现新的方法来测试这些想法的含义,将会取得重大进展,这些方法包含了解决这些假设的动态系统语言[14,196,198]。