原文链接:https://mp.weixin.qq.com/s/7FiddnQTR68BD0uaQuXwBQ
以下文章来源于集智俱乐部 ,作者Barack&Krakauer
来源: 集智俱乐部
作者:David L. Barack, John W. Krakauer
译者:JawDrin
审校:陈贺
编辑:邓一雪
导语
人类的高级认知能力怎样从包含上百亿神经元的大脑复杂系统中涌现出来,是神经科学的核心问题之一。学界中存在两种代表性的对立观点,神经科学家谢林顿(Sherrington)从网络的视角,强调大脑神经元之间的特定联系(网络节点信号),神经学家霍普菲尔德(Hopfield)则从集体行为的视角,强调神经系统中认知计算的分布式特点(神经元集体行为的空间嵌入)。这两种观点对神经科学发展都颇有影响。2021年发表于Nature Reviews Neuroscience 的综述文章,系统梳理了这两种观点各自的证据和应用,并讨论了未来整合的方向。该工作对于揭秘大脑工作模式、设计新一代人工智能具有启发意义。以下是综述全文翻译。
研究领域:认知神经科学,认知系统,大脑表征,集体行为

论文题目:
Two views on the cognitive brain
论文链接:
https://www.nature.com/articles/s41583-021-00448-6
目录
摘要
一、认知的神经解释
二、谢灵顿式观念
三、霍普菲尔德式观念
四、统一两种观念的可能路径
参考文献
摘要
认知可以被定义成大脑为了产生适应性行为而对有意义的表征进行的计算。在该领域的文献里大抵隐含两种关于认知与大脑关系的观念。谢灵顿式观念(Sherringtonian view)的一派试图将认知解释为网络中节点对信号进行操作和传递的结果,而大脑则是通过特定神经元以及它们之间的连接来实现这个过程。相对的,霍普菲尔德式观念(Hopfieldian view)的一派则认为认知是表征空间之间的转换或表征空间内移动的结果,并由神经元群体来实现。由此,霍普菲尔德式观念将特定神经元的特性以及它们之间的连接细节降为次要解释地位。只有霍普菲尔德方法具有必要的表征和计算资源,进而发展出新的神经功能对象以作为认知的首要解释器(explainer)。
引言
什么是思维?什么是决策、计划、信念、回忆、推理?——所有这些心理现象都与“某些事物”有关。这些基本的并且看似显而易见的观察对认知神经科学(cognitive neuroscience)的现状和将来的道路有着深远的影响。当代认知神经科学通常将反射等感觉运动现象的解释当做模型,尤其是动物模型研究。这种策略忽视了表征成分(representational components)对认知的重要意义。相反,解释这些认知现象的最佳模型依赖于计算,即大脑中导致行为产生的表征成分的转换。从动作到思维,对智能行为的解释需要一个更强的表征概念,而不是当前神经科学中广泛使用的用来解释感觉运动现象的较弱的表征概念。
当代神经科学中谢灵顿式观念认为,解释认知现象需要对由节点以及节点间的特定权重的连接所构成的网络进行描述,节点可以是具有生物物理细节的脑神经元或者是脑区。尽管这种对分子、细胞和回路的关注可能适用于简单的感觉运动行为,但我们认为它在适应解释认知所需要的语义表征(semantic representations)时是不够的。与谢灵顿式观念相反,霍普菲尔德式观念则强调神经空间的作用,在该空间中可从计算和表征的角度解释行为。尽管这些实体可能来自于神经元活动、离子流和生物分子过程,但霍普菲尔德式观念在解释认知时并没有纳入它们的细节。因此,与谢灵顿式观念不同,霍普菲尔德式观念对认知的解释始于表征和计算层面。
接下来,我们对这些观念做进一步的阐述。虽然许多研究者仍然持有谢灵顿式观念,在脑中寻求特定的通路和对神经细胞类型分类,但是在理解各种形式的神经组织(特别是细胞群体)如何实现表征方面的进展却非常迅速。新生的群体学说(population doctrine)支持了霍普菲尔德主义(Hopfieldianism),并对有主导地位的谢灵顿主义(Sherringtonianism)的神经元学说(neuron doctrine)提出挑战。革命正在进行,需要一项全面考察以概述这一新生观念的结构。在这一篇展望中,我们认为在描述认知表征和计算的神经现象方面,谢灵顿式观念的解释力有限,而霍普菲尔德式观念则有望揭示新的神经实体(neural entities),恢复表征在认知解释中的主导性地位。
一、认知的神经解释
认知是产生行为的表征计算。表征(representation)是在神经科学中广泛使用的术语,意指任何有信息的、指导性的神经信号。该信号含有身体或外部世界状态的信息,可用于指导行为。
与这种神经科学用法相反,我们认为,认知需要更精细和限制性的对于表征的概念。表征是具有内容的--即与某些事物有关。表征是可评估的,如真实性、成功性、准确性等。表征是可分离的,没有典型诱因时也可存在。它们可以以各种系统的方式组合和交互。最后,它们由系统产生和使用,进一步产生行为。明确的说,这些对表征的限制意味着并非每个感觉或运动状态都是一种表征。例如,如果一个特定的感觉运动状态在没有其典型诱因的情况下不能被激活,那么该状态就不是一个表征。在我们看来,认知是大脑中有限类别的信号转换的结果,在这个更强的意义下,这些信号仅涵盖那些携带表征性内容的信号。表征现象背后的功能与简单的感觉运动转换在本质上是不同的,并且我们认为这些功能需要一个本质上不同的实体。哲学也因这点而涉及其中。
我们承认对该术语的使用与当代神经科学对该术语的使用存在偏离的情况[2-10],但这受限的表征与神经科学又有什么关系呢?这些属性不应被视为对“表征”一词的严格限定,而应将其视为关于如何理解神经科学中认知解释所假定状态的计算作用的提议。例如,表征的可分离性是对神经系统的因果结构的一种主张。具体来说,须形成一个表征可分离的解释,使得表征的存在不受刺激约束:即使在表征的内容世界中没有刺激的情况下,表征也可以发生。但这意味着任何需要刺激输入来诱导这种表征的模型都是错误的。例如,越来越多的证据支持的一个假设:下颞叶皮层(the inferotemporal cortex)包含对象的表征[11-15]。这些发现通常依赖于启动处理级联的图像呈现(例如飞行中的飞机),这诱导了与图像类别(例如飞机)相关的神经活动。但是物体的真实表征在没有飞机的情况下也应能发生。我们并非想说下颞叶皮层在这种更丰富的意义上不包含表征,相反,这种表征存在的各种证据有待收集——例如在计划旅行、想象飞机飞行或讲述去年夏天去夏威夷度假的故事的过程中的飞机表征。显然这需要更精巧的行为范式和计算模型来描述这种行为。此外,其他属性也需要更准确的描述。与这种更受限制的理解相匹配的表征是语义表征(semantic representations),同时其携带的信息就是语义内容。
我们不只关注表征也注重计算。这里计算包括如何转换、更新、创建或删除表征。这些转换一般通过信息处理操作来完成,例如缓冲、过滤等。这种神经计算在表征上以扩展和认知下的形式进行,进而导致显式行为或内部系统的变化,同时该计算也是认知的基础。表征的转换对于理解认知是必不可少的[16],却经常被忽视[17,18]。但这样的转换不容忽视。仅仅解释表征不能够解释行为如何产生;必须识别转换并阐述它们的神经实现。认知神经科学专注于解释大脑中以表征计算的形式概念化的认知现象。
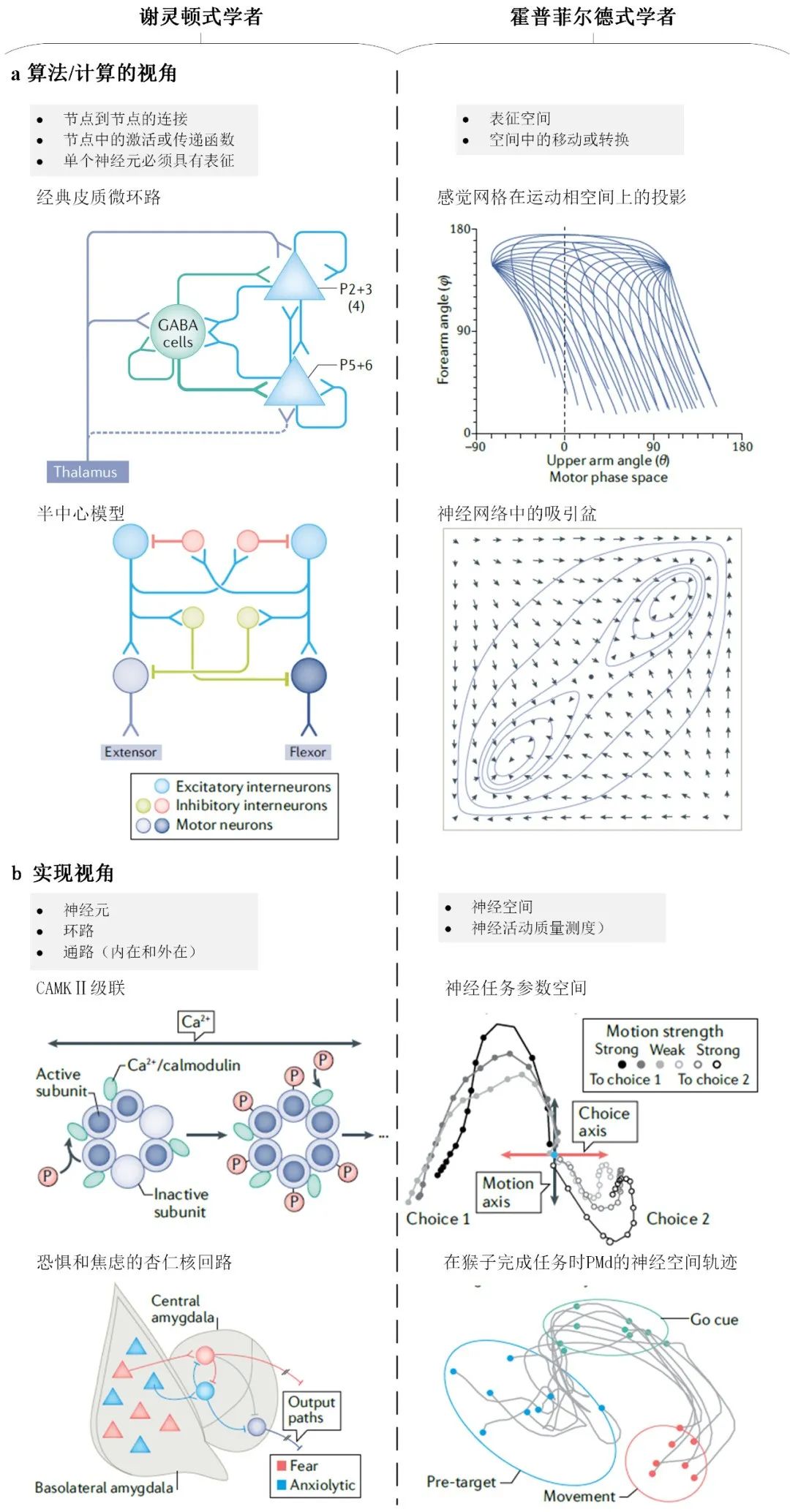
图1:谢灵顿式观念和霍普菲尔德式观念的对比和比较。谢灵顿式观念和霍普菲尔德式观念的概述。谢灵顿式观念探求将认知解释为点到点结构中节点的信号转换,而这些节点以及之间的连接与大脑中嵌入在回路和通路中的神经元相对应。在算法/计算层面上,谢灵顿式观念(a部分,左图)把节点到节点连接的特定模式的结果解释为认知,在这里单个节点转换表征。这种特定模式的一个例子就是经典的皮质微回路模型(图1顶部),在该模型中,皮质第4层神经元中锥体神经元(P)接收到的输入被转换和投射到第2/3层然后再传递到第5/6层。第二个例子就是反射的半中心模型(图1底部),在该模型中,兴奋性中间神经元和运动神经元表现出与中间神经元的刻板连接以实现相互抑制和交叉抑制。在实现层面,谢灵顿式观念(b部分,左图)详细描述了神经元、回路以及细胞内和细胞外通路,从而在算法/计算层面实现这些回路。比如,细胞内的 CAMKⅡ级联是由于自磷酸化而在细胞内持续活跃的分子级联。杏仁核中恐惧或焦虑的特定回路涉及基底外侧和中央杏仁核之间不同模式的神经元连接,每个情感过程都有专门的输出路径。
相比之下,霍普菲尔德式观念致力于表征空间,计算便是这些空间之间的转换或空间内的移动。在算法/计算层面,霍普菲尔德式观念描述了表征空间和认知系统在空间中移动或转换空间的方式。比如,一个简化的示例(图1顶部,REF129)描述了从视网膜坐标中编码眼睛位置的空间投影如何度量地变形该空间以编码上臂和前臂角度空间中的手臂运动。在实现层面,则可使用神经活动质量度量的方式(如许多神经元群的记录)对神经空间实现表征空间和空间转换进行评估。在感知决策任务中,把前额叶皮层的神经活动绘制在一个任务变量空间时神经轨迹就会出现,该空间由选择轴和移动轴组成,分别代表选择的方向和随机移动点场的相干程度(证据强度)(图1顶部,REF75)。神经活动沿着移动轴进一步投射,以表示点移动刺激中的证据强度。神经轨迹在运动规划的背侧前运动神经元中也有观察到,其中群体活动在每个试验中通过相同的状态序列(浅灰色线),以便在下游群体中设置运动参数。
图片来源:a部分(图1左上角)经REF.128, Elsevier许可改修;a部分(图1左下角)经REF.51, Elsevier许可改修;a部分(图1右上角)经REF.129, Springer Nature Limited许可改修;a部分(图1右下角)经REF.61, PNAS许可改修;b部分(图1左上角)经REF.130 Springer Nature Limited许可改修;b部分(图1右上角)经REF.75, Springer Nature Limited许可改修;b部分(图1左下角)经REF.131, Springer Nature Limited许可改修;b部分(图1右下角)经REF.132, Springer Nature Limited许可改修。
二、谢灵顿式观念
1、谢灵顿式观念定义
认知解释的谢灵顿式观念强调大脑中神经元之间的特定连接(图1),主张认知可以像Sherrington解释反射一样被解释 [19-21]。在这种观念中,神经元与神经元之间的连接以及这些神经元所执行的计算或其所嵌入的可追溯的回路是认知的一级解释器(方框1)[22]。这个观念对20世纪的神经科学至关重要,且给出一系列中枢神经系统(Central Nervous System,CNS)现象的见解。
在实现层面,谢灵顿式观念使用生物物理学和生理学术语,描述实现认知现象的神经元以及它们之间的连接。这些描述包括特定的神经传递函数:单个神经元对其输入执行转换,该过程通常在树突树或轴突小丘中发生。描述还包括特定神经递质的信息,比如它们在神经信号传导中的不同作用,以及局部回路连接的细节:哪些神经元与哪些神经元相连。认知现象的一级解释器是由特定神经元间连接所组成的回路,该回路由具有固定生物物理特性,并利用特定神经递质传递信号的特定神经元实现。
在算法层面,谢灵顿式观念倾向于通过具有加权连接的节点网络执行计算。在大脑中,这些节点是神经元,连接是突触。神经元对从网络中其他神经元接收到的信号执行专门的计算转换。认知解释则描述为:单个细胞摄取信息,通过神经传递函数转换该信息,然后输出到其他细胞。这个计算点超出了单纯的实现,因为同一回路可能有不同的实现[23]。谢灵顿式观念在计算和表征的算法描述中省略了细胞类型、生物分子、神经递质等生物生理学细节,因此它们的描述满足“中等独立性”(medium independence)(见方框2)。该框架假设:认知像反射(相互抑制)、眼球运动(神经积分器,neural integrator)和中心模式生成器(半中心模型,half-centre model)一样,符合谢灵顿式算法抽象形式。谢灵顿式概念算法最值得注意的例子可能是试图用单一经典回路来解释皮层活动,即1970年提出的不同皮层中神经元间的特定连接模式,用于解释所有多样性的皮层活动[24-26]。因此,在谢灵顿式观念中,对认知的解释一般采取计算的形式,该计算由单个神经元以及神经元之间的连接传递的信号所进行。
方框1:解释的层级
1,2a 3a,4a 2b,3b,4b 解释的层级:窗户为什么破裂? 1 窗户因球撞撞击而碎 2a 球的速度和动量解释了为什么窗户会碎 2b 窗户因为很脆所以会碎 3a 球的投掷方式解释了球的速度和动量 3b 玻璃的分子结构解释了玻璃的脆性 4a 投球的生理学解释了投球的动作 4b 玻璃的制造过程解释了玻璃的分子结构 4c 玻璃的分子结构可以通过玻璃的制造过程来解释 …… 两种关于如何解释认知神经基础的观念在认知的一级解释内容上存在根本分歧(见图)。解释级别是解释中实体的相对重要性。在解释窗户为何破裂时,球的速度、方向和硬度比球或窗户的微观物理成分更重要。相反,如果想解释球的速度和硬度,这两个属性将分别从球的投掷方式和球的分子组织方式来解释,从而将这些细节放在下一解释级别。如此,关于球是如何被抛出的,以及为什么分子是这样组织的,解释器便处于第三级别。对于给定的现象,第一解释级别是指解释中提到的实体和属性;第二级别是指解释第一层实体和属性的实体和属性,如此继续扩展。二级解释器解释一级解释器的能力不会赋予它们一级解释器的地位。每个级别解释器都是必不可少的,而不仅仅是占位符。然而,这并不是否认二级解释器在解释一级现象中的重要性。从这种解释观看,谢灵顿式观念和霍普菲尔德式观念为认知设定了不同的一级解释器。前者认为,认知的一级解释器是单个神经元及其细节的连接;后者认为认知的一级解释器是神经空间的属性。 |
方框2:Marr 三层次分析 Marr[133]描述了分析系统的三个层次。在这里,为分析认知,我们从这个经典观点中给出改进的分析方法。对于第一层,Marr将之表示为“计算”层,但我们称之为“生态”层[134]。该层描述了有机体面临的问题以及有机体如何解决该问题。比如,有机体必须跟踪的变量是什么以及它们是何转换的?为什么要跟踪这些变量并以这种方式对其进行转换?这描述了有机体必须做什么以及为什么它必须这样做才可以解决这个问题[135]。 在第二层,即算法层,描述了执行在生态层指定的计算过程。比如,有机体的功能特性是什么?它们如何跟踪和转换在生态层面指定的变量?系统中有哪些基本操作(如if-then语句、for循环等)?如何组合基本操作来执行更复杂的操作?以什么顺序执行基本操作或组合功能?在算法层,指定了用于处理系统中信息的基本表征和计算集以及这些操作如何组合(即架构)。重要的是,在算法层指定的架构能由不同类型的物理系统实现,例如计算机或大脑(中等独立性[136])。 在第三层,即实现层,描述了算法的物理实现。比如,系统是由什么组成的?系统的物理部分是什么?这些部分做什么以及这些部分和活动是如何组织的?实现层描述了物理过程,其活动实现了算法层描述的操作。 |
2、谢灵顿式观念阐述
运动感知和辨别研究中展示的解释类型阐述了谢灵顿式观念[27-30]。该研究计划研究了猴子如何将从嵌入随机点噪声中的一致运动点的模式的感知信号转换为这些点主要运动方向的决策。将区分运动方向的能力分解为一系列处理步骤,由单个神经元转换信号后,传递到处理链中的下一个神经元(图2)[32,33]。V5/MT(Visual cortex,V5/MT为其中一个区域)区域含有对视觉刺激中运动速度和方向敏感的神经元[34-36]。考虑该区域中的单个神经元,在谢灵顿式观念中,该神经元是计算运动刺激的速度和方向的局部回路的一部分,通过连接到特定的上下游神经元对回路发生作用,通过对其接收到的输入信号进行转换,然后将转换后的信号传递到下一个处理步骤。这些转换是通过特定类型的突触操作(如整合)实现的,且由细胞和细胞内离子流(如Ca2+、K+、Cl-等)之间的特定信号分子(在大锥体细胞的情况下可能是谷氨酸)或细胞内的大生物分子进行传递。
作为该处理流的一部分,MT神经元投射至外侧顶叶区域的神经元[37]。当向受试者展示运动证据时,外侧顶叶区域的神经元显示出一种刻板的上升活动模式,该模式在眼球运动开始之前逐渐增强,以指示运动的方向[29]。该活动已被建模为将证据整合在一起,以决定运动的方向[33]。尽管这些发现最近受到挑战[38,39],但该研究计划仍然很好地阐述了谢灵顿模型对认知的解释。
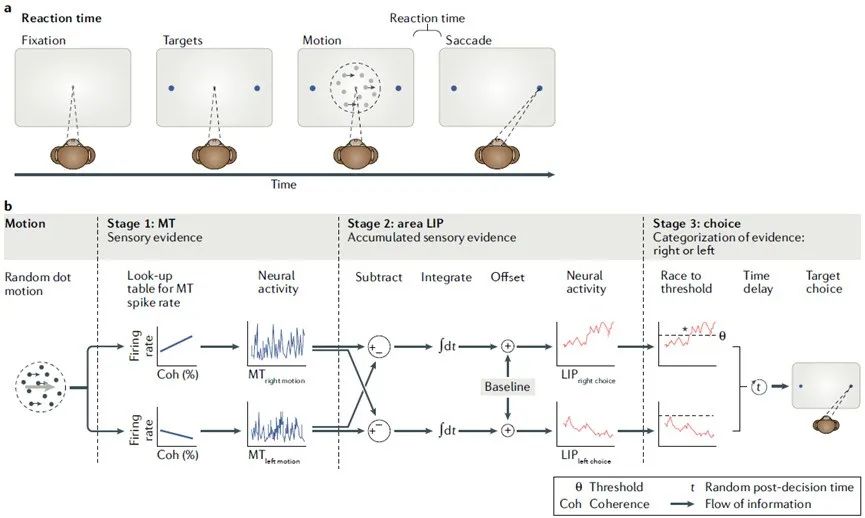
图2:运动方向决策研究的描述阐明了谢灵顿式观念。a.随机点运动任务。当两个目标出现时,猴子首先注视然后保持注视,然后是一个中心呈现的随机移动点场,其中一些点一致地移动。然后,猴子会通过眼睛向相应方向的目标移动来指示他们对运动方向的决定。b. 用谢灵顿式术语解释决策。运动证据的表征,即关于点移动方向的证据,由MT区域中的神经元携带。然后,该信号沿专用路径发送到外侧顶叶区域(LIP区域)。LIP区域的神经元整合来自MT的运动证据,形成证据总和的表征。这种表征表示阈值,指示下游动作的选择和启动。之后形成运动:向猴子显示方向和强度变化的随机点移动(沿相同方向移动的点的百分比)。第1阶段,MT区域:该区域中的建模神经元表现出与运动方向和强度相关的噪声放电率。第2阶段,LIP区域:该区域中的建模神经元整合了从MT中建模神经元那里接收到的运动信号。LIP区域神经元输入是左右偏好MT神经元之间差异的总和。LIP区域神经元表现出与MT神经元运动偏好方向匹配的响应偏好。该输入随时间累加,添加基线偏移后,建模神经元表现出与该总和相关的噪声信号。第3阶段,选择:LIP左右选择区域的神经元放电率随其输入成比例增加,首次通过阈值时便形成了确定的目标选择。| 来源:a和b经REF.32, Oxford University Press许可改修。
总之,动物在嘈杂的感觉条件下做出知觉决定的能力可以解释为:神经元从运动处理区域神经元接收知觉信号后进行整合,进而总结运动证据。概况的说,回路执行了所需的计算,回路概念化为一系列处理步骤,每个处理步骤由适当连接在一起的单个神经元执行。类似的,可以想象一个更抽象的操作回路,例如在何处收集信息、如何制定长期计划或如何在两个未来决定之间进行选择。谢灵顿式观念致力于使用组成回路的神经元之间点对点的通信来解释认知。
3、谢灵顿式观念存在的问题
近来,谢灵顿式观念受到严厉批判。如有批判指出该方法无法解释刺激特性的组合[40]。这种抨击源于对感知器(被称为第一代人工神经网络[41])的批判。该批判指出这些简单的人工神经元无法执行异或(XOR)逻辑运算[42]。例如,假设我们需要将刺激分类为猫或狗,而不是这两者同时,线性前馈单层人工神经网络无法实现这个简单的异或析取分类功能。而排他析取问题却成为霍普菲尔德式观念的最重要动机之一(图3c)[40,43]。
作为对感知器的批评,XOR挑战是站得住脚的。然而,问题不在于感知器,而在于生物神经元。但请注意,对于执行XOR计算的单个神经元没有概念上的先验论据。例如,假设神经元A和B都在神经元C上形成突触,A上的权重为–1,B上的权重为+1,当且仅当C活动的绝对值大于+0.5时,神经元C才会发放。并假设输入是加性的,激活神经元处于状态1,非激活神经元处于状态0。那么,当神经元A和B都处于激活状态时,它们的输入将抵消;但如果只有一个神经元处于激活状态,则神经元C将处于激活状态。那么作为一个概念点,对单个神经元的输入进行异或计算是没有障碍的。
诉诸特殊连接的三元组的解释无法扩展:对于每一种可能的异或分类,都需要一个专门回路(即一个巨大的查找表),这是非常不切实际的[1]。此外,由于绝对值运算,只能使用非线性函数计算XOR,虽然谢灵顿式观念并没有要求单个单元只能执行线性运算。然而,该示例提出了一些有趣的问题:对于XOR问题的某些子问题,若假设非线性读数以及正负权重,便可能会存在专用的神经元。即使我们放宽这些假设,增加一些其它假设,该结论仍然成立。许多文献都提到了单个神经元的计算复杂性这一点[44,45],而且至少在离体实验中,已经在海马神经元[46,47]和来自皮质层2/3的人类神经元中观察到 XOR 计算[48]。
人们通常使用群体层面现象来应对神经元之间连接重要性的挑战。这些包括混响活动(reverberating activity)[49]、细胞集合(cell assemblies)[50]、中央模式发生器(central pattern generators)[51],甚至大脑区域之间的振荡通信[52]。此外,许多新的神经数据模型都涉及从高维数据中揭示低维潜在结构[53-55]。然而,谢灵顿式方法可以产生群体层面现象。只要每个神经元根据其特性在电路中扮演特定角色,该方法就可以容纳各种形式的群体编码或计算。如果将产生低维动力学的特定神经元回路作为第一级解释器,那么嵌入式潜在低维动力学的重要性也可以与谢灵顿式观念一致。例如,有研究项目正在研究是否可以根据局部回路模式的分布来估计神经群体的维数[56-59]。在谢灵顿式观念中,神经元组作为整体可以在计算中发挥作用,但它们不会是解释认知现象的第一层次。核心解释由单个神经元及其相互连接来完成。仅当试图用局部回路方式解释认知现象失败时,群体层面计算现象才会对谢灵顿式观念造成冲击。
三、霍普菲尔德式观念
1、霍普菲尔德式观念定义
与谢灵顿式观念相反,霍普菲尔德式观念强调神经系统中认知计算的分布式特性,正如Hopfield描述的分布式神经网络如何执行计算一样[50,60-65]。该方法以神经空间之间的转换来表示其操作和表征。在实现上,神经元的集中活动由一个神经空间描述,在其中嵌入了一个低维表征流形[66]。这些神经空间可能由神经集合[50,67,68]、大脑区域[67,69]或整个大脑的分布表征[70]组成。这些表征和转换是通过神经元或其子成分的聚合作用实现的,但对认知的解释不需要包括对神经元或其详细相互关系的生物生理学描述。单个神经元只能作为认知现象的二级解释器发挥作用,仅通过它们对神经空间的影响来解释。极端情况下,霍普菲尔德式观念完全避开了单个神经元的细节[71]。
从算法上讲,霍普菲尔德式计算由作为基本实体的表征空间和在这些空间内移动或从一个空间到另一个空间转换的基本操作组成。这些表征就是神经元实体实现的状态空间中的吸引盆(无论是单个神经元、神经群体还是其他神经生理实体),但与实现细节无关(事实上,尽管大多数霍普菲尔德式计算都集中在神经群体上)。参数空间描述了表征空间的变化维度。这种表征观点与哲学中的 quality-space 方法共享内容概念化[72,73]。对这些表征的计算就是空间之间的转换或在其中移动,并根据表征空间的动态特征进行描述,例如吸引子、分岔、极限环、轨迹等。简而言之,认知功能是经由神经空间和系统在该空间内部或空间之间的移动来实现的[16,18,40,66]。
2、霍普菲尔德式观念阐述
在霍普菲尔德式观念中,单个MT神经元因其作为群体一员而具有解释作用,该神经群体共同组成表示运动的神经状态空间。视觉输入激活或抑制该神经元,使其活动有助于塑造神经空间随时间变化的方式。这种多维神经活动空间是单个细胞放电和其它非尖峰特征神经活(如膜动力学和神经元相关性)的结果。在这个神经空间中嵌入了一个表征流形。系统在这个空间中所占据的点表征其运动速度和方向。认知的潜在计算也仅在神经空间层面发生。可再次以外侧顶叶区域在嘈杂的感知决策中的作用为例。事实上,该区域表现出的反应多样性与上述谢灵顿式观念相悖,而且表明可能存在群体层面上进行整合和表征计算的证据[74]。许多神经元并未表现出整合作用,但是将这些神经元的神经活动结合起来可明显看到整合的模式。在类似的任务中,前额叶皮层记录到的神经活动到任务相关变量定义空间(即表征空间[75])的低维投影表明存在证据整合。在霍普菲尔德式观念中,神经生物学和表征被整合在一起,因为低维表征空间嵌入在高维神经空间中。
霍普菲尔德式观念对表征空间的强调使其获得了谢灵顿式观念无法获得的解释力。以对简单记忆任务中错误的解释为例(图3)[76,77]。在这项任务中,受试者首先观察一个刺激或一系列刺激,然后是延迟,然后展示进一步的刺激。受试者必须记住这些后来的刺激是否与最初呈现的刺激相匹配,然后从一组不匹配的干扰物中选择匹配的刺激。对在此任务期间得到的外侧前额叶皮层的神经记录,先通过解码任务类型(回忆或识别)或任务中使用的线索进行分析[78]。在解码分析中,根据某些神经度量(例如观察到的神经元的活动)训练网络从而对某些刺激或条件进行分类。在这里仅仅分析有纯粹选择性的神经元,即那些仅对一个任务变量(例如提示或条件)在自身放电率上有主要影响的神经元。接下来,对仅显示混合选择性的部分神经群体进行了另一次解码分析,也即这些神经元的放电率受条件或线索的组合调节。在这两种情况下,解码的准确性都超出了偶然性。然后估计神经群体活动的维数,即神经群体活动可以独立变化的方式的数量。当包括混合选择性时,对维度的估计会更高。重要的是,神经群体在错误试次中比在正确试验中显示出更低的维度,如果在解码中排除非线性混合选择性,这种差异就会消失。错误试次中总体维度的坍塌反映了总体中表征能力的降低,并有助于解释在这些试次中犯下的错误。总之,描述群体活动所需的独立维度的数量可用于解释认知行为现象。因为非线性混合选择性神经元会产生更复杂的表示空间,所以这些神经元是必须的。这样的解释是霍普菲尔德式观念方法的典型例子。
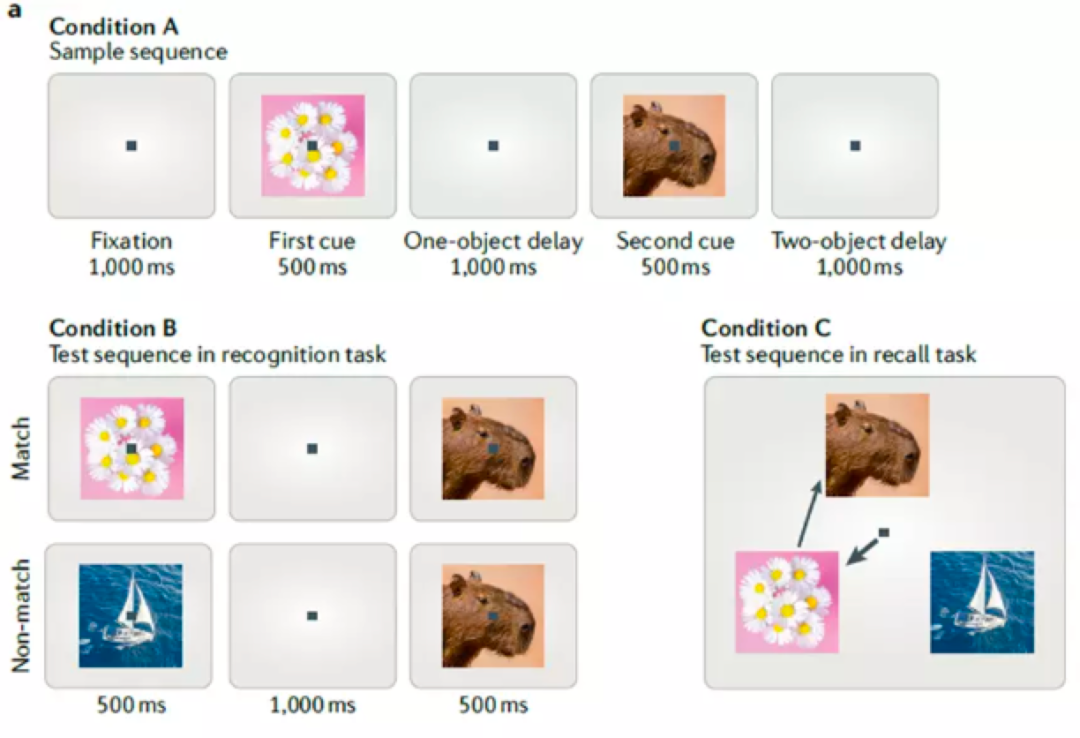
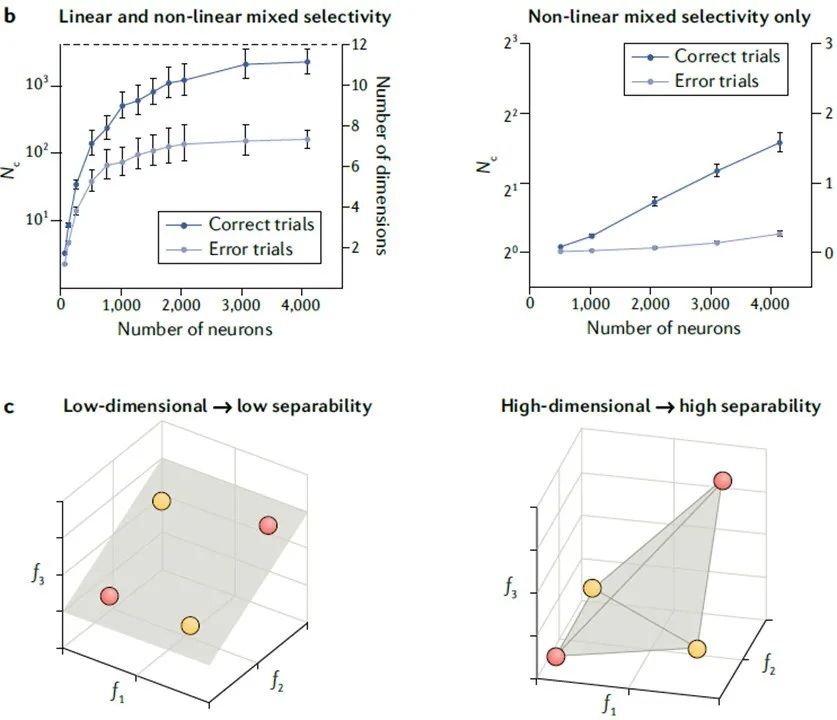
图3:延迟回忆研究的描述阐明了霍普菲尔德式观念。
a.延迟匹配示例任务。条件A:任务的样本试验序列。猴子首先注视方块中心1,000ms,然后展示一个示例图像500ms,在延迟1,000ms后,展示第二个图像500ms,然后是第二个 1,000ms的延迟。之后要求猴子根据任务以不同的方式做出反应。条件B:识别任务序列。在条件A的第二次延迟之后,猴子会看到第二种两个图像的序列。第一个图像展示500ms,延迟1,000ms后,展示第二个图像500ms。当第二个图像序列与条件A中的原始序列一致时,就会发生匹配;当第二个图像序列与原始序列不一致时,匹配就会失败。猴子必须指出第二个序列是否匹配。条件C:回忆任务序列。在条件A的第二次延迟后,展示三个图像,要求猴子须按照显示的顺序选择条件A中原始序列显示的两个图像。
b.表征空间的维度(即维数)与神经元的数量相关以及试验的正确与否。这种维度是群体特征并且不能简化为单个神经元;因此,这种解释不适用于谢灵顿式观念。左图:在一系列群体规模中,正确的试验比不正确的试验具有更高维度。x轴表示分析中使用的神经元数量位,左侧y轴表示二元分类数 (Nc) 。二元分类数是被正确分类的任务条件数量,即在给定性能阈值(阈值在75-80%之间[78])的条件下,训练的分类器正确分类(1表示条件C,0表示非条件C)的数量。是一个分类器可以被训练以对正确分类的给定性能阈值进行分类的任务条件的数量。右侧y轴上的维数是二元分类数的对数函数。右图:与左图一样,但删除了每个神经元的线性作用。与错误试验相比,正确试验仍然表明维数有增加。
c.基本逻辑运算需要增加维度(f1、f2、f3是表征空间的维数)。左图:使用异或规则时,无法用平面对项目进行分类——在平面上无法画出直线将黄色项目与红色项目分开。右图:变换到三维中允许线性分类器正确分类项目。| 来源:a和b经REF.78, Springer Nature Limited许可改修;c经REF.40, Elsevier.许可改修。
3、霍普菲尔德式观念所面临的问题
霍普菲尔德式观念面临着许多明显的困难。比如单个神经元携带信息的例子比比皆是,这些例子存在于感觉(例如,A1(Auditory cortex,A1为听觉皮层的一个区域)中的音调、试听中的耳间时间差计算、体感特异性或整个视觉系统的大量发现)、导航(内嗅-海马皮质中的网格细胞(grid cells))或学习(例如多巴胺细胞传达的时间差异预测误差)中。下面以网格细胞在内嗅皮质和海马皮质中的作用为例进行说明[79,80]。网格细胞是动物发现自己所处空间位置的神经元[81-83]。这些细胞(以及内侧颞叶中的许多其他细胞)似乎具有特定的表征性内容,因而被认为在解释空间认知和导航方面发挥核心作用,构成环境的认知地图[84]。同时也被认为在内部定向认知搜索中发挥作用[85,86]。这种单神经元表征似乎与以神经群体为核心的霍普菲尔德式方法相悖。
然而,霍普菲尔德式观念否认这些方法的解释能力,因其将计算而非仅仅信息相关性归因于单个细胞。单个神经元的选择性反应在解释上是衍生的,相反,神经空间扮演着核心的表征性地位。然而请注意,主张群体活动存在却不足以对抗由位置细胞、网格细胞和其他单个神经元中的选择性反应给出的反驳。如上所述,谢灵顿式观念可以接受群体编码,因为在这种情况下,这些编码是对导航能力的解释,因为群体是由单个神经元以及它们之间的相互连接组成。霍普菲尔德式观念必须保持解释的顺序与谢灵顿式观念相反:单个神经元的反应之所以具有解释能力,只是因为它们是更大群体的一部分。作为对这些神经空间的解释,单神经元的发现充其量仅在第二层具有解释作用。此外,单神经元相关性并不意味着相关计算发生在该级别。相关性并不意味着计算。例如,单个神经元的活动,即使其在行为上与内部活动或环境变量相关,并不意味着该活动的计算作用,因为这种相关性可能具有其他非认知生物学功能。此外,嘈杂的复杂系统(例如大脑)通常包含虚假的相关性。尽管如此,一些单细胞反应可以为所表征的内容提供线索。
例如,霍普菲尔德式观念可以将网格细胞响应归咎为经训练和反馈塑造的活动,这是群体层面处理的结果。在这种观念中,学习过程创建了一个自然导致网格细胞形成的神经空间。这个神经空间是解决有机体面临的生态问题的结果,即编码主体位置的问题。例如,路径积分的最优解对应于傅立叶空间中的一个环[87]。一旦这个环被实现,网格细胞就会在网络中发展[88,89]。
两种回答都说明了霍普菲尔德式观念可以依赖更一般的策略。认知状态空间嵌入在高维神经空间中。任何给定认知空间中的活动都可以显著地驱动单个神经元。在这种策略下,显著的单神经元活动实际上可能从群体活动中出现。持有霍普菲尔德式观念的学者关注神经和表征状态空间,认为群体是通过神经网络操作的一般性原则而不是凭借构成群体的神经元的详细连接规范来执行计算和构成表征的。因此,这种观念强调聚合神经活动,并认为单个神经元的解释能力来自它们在群体中的成员身份,而不是来自于与该神经元的连接。相比之下,谢灵顿式观念必须坚持认为,群体活动是由单个神经元的活动及其特定连接构成和驱动的。对这种观念来说,连接非常重要;而霍普菲尔德式观念则不是这样。另一种直观区分两种观念的方法就是要意识到,通过状态空间的轨迹是不变的,与从群体中采样以生成它们的具体神经元无关。认知不仅仅是神经空间与特定一组已识别神经元之间特定连接模式的一一对应关系。
除了单神经元现象之外,许多研究也揭示了区域之间的特定连接模式。大脑的接线图(wiring diagrams)非常复杂,包含几十个区域,它们之间有特定的通路[90]。事实上,决定区域之间的连接可能来自于基因,这在解释各种能力(例如视觉能力)中发挥重要作用[91]。霍普菲尔德式观念也必须考虑到这种特殊性。如果群体动力学(population dynamics)是一级解释器,那么为什么大脑会表现出如此特殊的布线?
对此,霍普菲尔德式观念也有一些回答。最佳的回答可能是接线图是视觉处理的二级解释器。一级解释器是每个区域的群体动态,布线有助于解释这些动态。适应区域之间特定连接的另一种方法是允许群体相互连接,但区域内或区域之间神经元到神经元连接的完整规范不是必须的。这种观念强调神经空间中的活动,但对信息如何在这些空间之间传递保持不可知论。极端地遵循霍普菲尔德主义而坚持排斥大脑中所有区域的特定功能是没有必要的[70,92]。
四、统一这两种观念的可能路径
认知神经科学家对描述大脑的功能结构很是感兴趣[93,94]:即大脑为认知而进行的基本表征的计算操作。谢灵顿式方法和霍普菲尔德式方法分别提出了最好地描述和揭示大脑功能结构的不同假设。有不同的方法可以对这两种观念之间的关系进行分析。
1、争论的解决
此处讨论的两种观念之间的所有争论,如果在特定的框架下,则由来已久。在这个框架中,谢灵顿式观念强调神经元之间的连接,这与霍普菲尔德式观念强调的神经群体形成对比,因而该争论涉及神经元学说[20,50,63,95-99]和群体学说[18,66]。神经元学说最初是为了反对网状主义而制定的,但现代的化身强调单个神经元在大脑信息处理中的作用。之后这种分歧演变为神经元学说和群体学说之间的冲突,前者认为单个神经元是认知的基本解释单位,而后者认为神经群体将发挥中心解释作用。
但我们并不认同这种相当平庸版本的争论。为了对单个神经元或群体的作用有更合理的看法,此处已对这两种观念进行更新阐述。事实上,这两种观念都承认单个神经元和神经群体的重要性。首先考虑强调单个神经元的谢灵顿式观念。因为需要不止一个神经元就认为这个观念是错误的,这样既
友善也不准确。从未有人相信视觉场景可以被单个视网膜细胞捕捉到。对神经元学说最宽容的解释是:并不认为单个细胞,而且只有单个细胞,是认知或任何行为现象的解释者。相反,神经元+学说(neuron+ doctrine)认为单个细胞及其相互联系是认知现象的解释器——这集中体现了当前神经科学中非常盛行的“回路破解”法(‘circuit-cracking’ approach)。通过强调神经元间特定的连接所赋予的功能,神经元+学说可以适用有关神经科学中的发现。神经元+学说与谢灵顿式观念无异,后者需要神经元间的回路规范来解释认知,就像简单的感觉运动现象一样。此外,就神经群体是理解认知现象的核心而言,谢灵顿式神经科学的拥护者可以强调,神经群体通过其单神经元成分所执行的连接和转换来发挥作用。
反过来,霍普菲尔德式观念可以承认单个神经元的重要性。不可否认,单个神经元对群体活动有贡献。然而,神经元之间的特定连接与认知的一级解释器是没有关系的。对霍普菲尔德式观念最宽容的解释是:提出了一种群体+学说(population+ doctrine),即由单个神经元构成的细胞群体是认知现象的解释器。由此,群体+学说(与霍普菲尔德式观念无异)可以将关键细胞的活动同化为特定情况下群体活动的主要驱动力。认知现象总是由群体的作用产生的,不管是由单个细胞驱动还是受许多细胞的影响。只有当我们转向解释这些群体现象本身时,那些单个神经元及其点对点的组织才会突显。
因此,仅仅将谢灵顿主义者和霍普菲尔德主义者之间的差异描述为神经元学说和群体学说之间的差异是不正确的。两种观念都没有否认神经群体和单细胞都很重要,并且这种重要性可以与任何一种理论主张相协调。因此,仅仅神经元或群体的参与并不能确定主导观念,同时我们发现单个神经元和神经群体之间的差异是比较小的。在两个观念中都包含单个神经元或群体的可能性是否表明这两个观念比我们所阐述的更加接近?它们的分歧可以调和吗?
2、替代或简化
在替代的道路上[66],霍普菲尔德式方法提出了一种新的群体+学说,它将取代旧的谢灵顿式方法。在库恩经典模型(Kuhn’s classic model)中[100],当一个领域面临当前理论或学说难以解决其面临的问题时,就会产生科学革命。排他析取[40,42,43]和前额皮质反应的多样性[75]都对谢灵顿式神经科学提出了挑战。作为面临问题的回应,群体+学说,即霍普菲尔德式观念,已经形成了自己的分析、工具、技术和概念类型。
然而,作为对革命可能性的回应,谢灵顿式观念可以转而尝试弱化霍普菲尔德式方法背后细胞到细胞的连接的现象。这种选择将需要发展出新的解释力来解决其面临的挑战,包括解决混合选择性和排他析取问题。但是,从根本上说,对霍普菲尔德式挑战的回应建立在一定希望的基础上,即希望对于执行认知操作的每一种方式,都会有关于神经元和局部回路连接的描述。使用一系列令人印象深刻的新工具研究昆虫认知的神经基础的努力就是这种类型的尝试行动[101,102]。然而,这种方法面临着诉诸本质上是通过二级解释器来解释认知语义成分的挑战。更不用说,我们对这一策略的可行性持怀疑态度。
3、调和
抛弃替代或简化方案,两种方法的不同可能反映了由进化或不同区域执行不同功能所导致的差异。谢灵顿式方法可能对脑干或脊髓等较老的、保守的或模块化的结构更有效。谢灵顿式回路是反映选择性进化结果的计算专用模块。神经元到神经元的连接和管状的局部回路便是选择性进化的一种结果。较新的、灵活的或新生的结构则可能需要霍普菲尔德式方法来解释。霍普菲尔德式回路是更灵活的模块,可用于一系列计算。这些功能不是进化选择的结果,因此将由没有专用功能或没有特化的大脑区域实现,以便在面对新挑战时对新信息处理进行复用[68,103]。用于计算的分布式群体活动将反映神经处理的结果,其目的是近似那些新的但必要的计算。例如,小脑和基底神经节坚持拒绝表现出通用功能,可能是将这两种方法应用于该问题而产生矛盾的证据。
其次,方法上的差异可能反而掩盖了共同点,这些共同点可以弥合两种观念以解决各自缺陷而不放弃两者的优点。一些认知神经科学家给出了可能构成神经认知计算的功能类型字典,这包括Fuster的cognits [104]、Arbib的大脑运作原理[105]或Carandini的经典神经计算[106]。哲学和神经科学中强调神经元动态联合的几种方法也让人联想到这种方法[67,68]。Wang在混响动力学的研究中有这种方法的一个简洁示例[49,107]。在感知决策的突触混响模型中,有关于这样基本功能类型的描述,适用于单个神经元和神经群体,而且现在已扩展到许多不同的认知功能当中[108,109]。然而,由于必须将功能类型组合成复合体以提供对目标认知现象的解释,因此它们充其量只是二级解释器。
4、革命
革命性的认知神经科学将在很大程度上解释和化解谢灵顿式观念和霍普菲尔德式观念之间的隔阂。两种观念都关注不同认知任务或不同大脑区域的相关神经现象。统一这两种观念的方法是意识到大脑实现的底层是有计算实体的。在某些情况下,这些实现采用单个神经元和特定连接规范的形式。这些回路启发了谢灵顿式方法。在其他情况下,这些实现采取神经元群体中的大规模活动的形式,而忽略单个神经元和回路。这些神经空间启发了霍普菲尔德式观念。但两者都是将表征转换为行为的计算实现的例子。
这种新颖的认知神经科学的描述在霍普菲尔德主义中有最好的跳板。谢灵顿式方法假设的详细程度限制了其可用的解释力,而霍普菲尔德式方法对此类的约束较少。这些限制在表征性和计算性上都很明显。
计算和谢灵顿主义。谢灵顿主义在表征方面备受批评,而霍普菲尔德式观念则避免了这一点。谢灵顿式观念需要将认知解释为特定神经回路的结果。认知来自执行其功能的专用回路,就像对特定回路执行其功能反射的解释一样。这意味着只能为单个节点分配语义内容。因而在这存在两个问题。
假设每个节点都分配有单独的内容。因为节点承载语义内容,并且不同的语义内容可以导致任何给定的运动,所以对于每一种这样的行为,谢灵顿式观念都需要一个必须包含不同节点的专用回路。例如,即使在不同例子中所有的手势动作都是相同的,但是并不是所有的手势动作都由相同的原因引起;求救手势与打招呼不同,因此在这种方法中,每个这样的手势都需要一个不同的回路[94]。但是对于引起运动的每种表征性方式,都需要一个新的神经元到神经元反射样通路,最终结果是回路资源的爆炸式增长[1]。或者,可以将多个内容分配给同一节点,也就是说这个神经元的放电率从m到n的范围表示“熊”,从n到r表示“荆棘”等等。这增加了系统语义组织的复杂性。认知的解释需要大脑根据其内容来转换表征,这意味着必须使用表征[9]。正如我们上面所概述的那样,表征由系统产生和消耗。然而,大脑可能不容易使用这种复杂的语义组织。
此外,谢灵顿式观念在复杂内容的表征方面也存在问题。考虑将“雪是白色的”内容分配给单个节点。原则上,这并没有错——早期的联结主义网络有时会明确地将内容分配给节点——但它这样就与激进的祖母细胞假说无异。这种类型的语义原子论容易使人信服[3]。或者,通过单个节点承载的语义内容进行组合可能会产生复杂的内容,一个节点代表雪,另一个代表白色,第三个代表谓词关系(如“snow is white”中的“is”)。但是,复杂的内容实际上根本没有被表示,因为在谢灵顿式观念中,语义内容的唯一载体是单个节点。虽然原则上不是错误的,但这样的描述与人类心理的许多方面背道而驰。以语言为例,句子是由词组成的,但句子的意义超出了词的意义,但在谢灵顿式观念中,这种延伸的意义并没有在大脑中表现出来。这非常不可取。
除了这些表征上的缺陷之外,谢灵顿式观念的计算力也大受限制。为了执行计算,这种观念在算法层面只有两个元素:节点和连接。其将计算限制在满足节点到节点描述的系统上。迄今为止,还没有人描述一种通过快速重新配置节点之间的连接来执行计算的方法。因此,计算必须能够由各个节点中的传递函数执行。但这也限制了系统可以执行的计算类型。首先,必须将分布式表征分析成单个节点可以承载和转换的内容。其次,如果只有局部表征,那么计算就不可能是多个成分的活动和交互的结果。这两个约束都限制了这种观念的可用计算类型。
计算和霍普菲尔德主义。相比之下,霍普菲尔德式观念在表征和计算上都更加灵活——以至于它的计算描述包含了谢灵顿式观念的那些。操作和转换真正发生在神经元到神经元描述层面上的认知系统,也可以认为是在以基本动力学术语为描述特征的神经空间中移动的认知系统。然而,反过来却不成立;但可能存在不满足这种点对点描述的认知系统。因此,霍普菲尔德式观念涵盖更多系统。
霍普菲尔德主义通过识别新的一级解释器来描述认知,这些解释器以神经活动中潜在对象的形式存在,并由高维神经状态空间的低维投影变化来描述。事实上,神经系统中的弥散或聚合作用可能占主导地位,以至于不需要专注于节点到节点架构的谢灵顿式计算框架,在多模态皮层中尤其如此。因此,这些对象的动作在换入或换出不同的神经元时保持不变,即使尖峰与实际表征相关,甚至神经尖峰也可能只是表象。
神经功能空间。这些新型一级解释对象同时具有神经功能属性(Neurofunctional properties)(图4)。在最近关于运动规划的研究中有这种解释模型的案例。在神经功能水平上规划可以解释为通过神经状态空间的轨迹,该状态空间导致用于运动执行的第二个动力系统的初始化[110-113]。状态空间中的轨迹编码了到目标的运动,相似的运动在真实发生之前引发类似的轨迹。这些轨迹的收敛对应于运动规划,该规划由运动目的设定,例如目标位置、轨迹形状和执行目标的等价类运动的其他特征[114]。这些轨迹是一种行为形式,他们本身是需要解释的不同任务和环境中的神经功能不变量。值得注意的是,在更全面的意义上状态空间中的这些轨迹具有表征性,因为出现在不同感官环境中的相同表征被用于控制运动,并且对误差和其他类型的精度相关的计算很敏感。这只是运动规划的一种形式,通过这些计划动力学初始化该系统,因为运动执行本身是由另一个系统中的旋转动力学控制的。在这种情形下,表征性实体指示非表征实体。
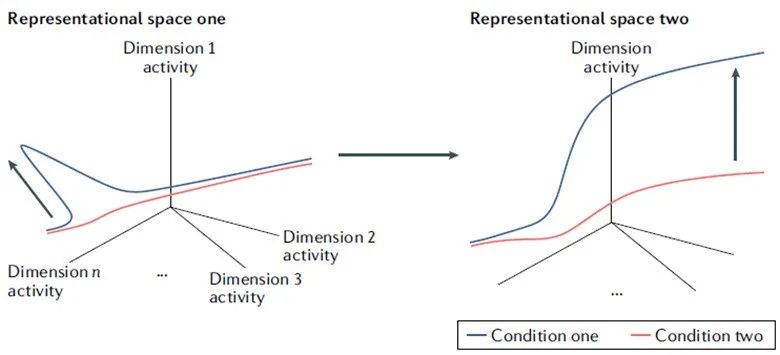
图4:霍普菲尔德式算法方法革命的阐述。算法层面的霍普菲尔德式模型由活动空间及空间之间的度量转换组成。表征是这些空间中的吸引盆,计算是空间之间的转换。在这里,条件一中,高维表征空间中的活动沿着某个维度发生偏移,而条件二中却没有。表征空间二有另一个维度,该维度表示在空间一中沿偏移维度的活动的积分。与条件二相比,表征空间二随着条件一的偏移沿该维度移动。因此,表征空间二显示出神经轨迹的分叉,这是一种既在认知中起解释作用的神经行为,又是将其本身解释为认知行为所需的神经行为。这组神经轨迹描绘了一个低维神经流形,这在谢灵顿式方法中无法用节点和连接来解释。此外,分叉的计算作用也需要进一步描述。
如果解释是以新的神经衍生的一级解释器为特征,这种解释方式可以推广到其他心理解释[115]。表征上,不同的语义内容被分配到潜在状态空间的不同区域,这些状态空间将它们的内容贡献给一系列认知现象,因此与我们的表征概念相一致。经济决策可能需要使用高维神经表征来解开价值信息从而形成价值表征[116]。成功的回忆需要神经群体中潜在的足够多的表征维度才能满足任务需求[78]。学习的难易程度取决于神经活动相对于嵌入在高维神经空间中的低维流形的位置[117]。皮质轨迹用于估计时间间隔[118,119],特别是,来自高维神经空间的低维投影的不同变异子空间代表额叶皮层中的不同间隔[120]。在贝叶斯时间估计任务中,低维流形的曲率表示先验,这是分配给状态空间中动态特征的明确表征地位,而谢灵顿式方法无法描述这个作用。从对神经计算的研究中可以看出同样的启示。例如,通过在任务定义的表征空间中的移动,前额叶皮层可以在依赖于内容感知的决策中发挥作用[75]。工作记忆依赖于通过低维流形的路由轨迹[122]。基于规则的推理和切换依赖于前扣带皮层规则证据的群体水平差异。这种多样化的表征和计算现象阐述了霍普菲尔德式观念的解释能力。
这种可以被理解的混合类型的一阶解释器的能力是霍普菲尔德式方法的一大好处。将每个认知功能分解为其子功能以及将其神经动力学可视化为状态空间的轨迹便可以解释认知现象。这些描述类似于费曼图,它为亚原子粒子相互作用的直观可视化提供帮助,否则这些粒子将是复杂且难以理解的[124]。这种理解被认为是科学解释的必要条件[125]。相比之下,最近对依赖连接度量的神经网络模型做出类似解释性声明的尝试又陷入谢灵顿式方法常见的缺陷中:提供晦涩的定量描述或测试模型,这些模型本身仅仅是连接而与表征和计算无关[126]。
鉴于霍普菲尔德式观念的解释力,这种观念下一步将会如何发展?这将取决于正在研究的认知现象的细节。但是,可以给出一些一般性建议。首先,神经数据不再仅仅具有实现细节的地位。相反,神经活动可以作为丰富的信息来源,伴随的行为可以用于构建认知理论。这是对神经数据不同的理解,强调直接从嵌入低维流形的神经活动中发现认知计算。
其次,实现霍普菲尔德式方法的承诺需要在定量和概念上进一步发展。低维状态空间中的轨迹显然是对表征的操作。但这些操作是什么?如何在数学上表示它们?这些数学特征与生态层面描述的有机体面临的问题有什么关系(方框2)?需要一种使用这些神经对象进行计算的新理论。此外,计算是表征的转换,但这些表征也是低维神经对象。状态空间转化如何对也是低维神经对象的表征进行操作?例如,简单地用线性动力系统来描述这些操作不足以将这些状态空间的行为与其生态功能联系起来。
第三,霍普菲尔德式系统需要与谢灵顿式系统交互[127]。显然,谢灵顿式回路与复杂神经系统的输入端和输出端相关,如感觉器官或脊髓。霍普菲尔德式回路处理的信息通过谢灵顿式节点和连接过程进入系统,霍普菲尔德回路对行为的影响必须经过最终的共同通路以及谢灵顿式节点和连接回路传输信号,这些信号源于皮质,走向躯体,然后与骨骼肌系统相互作用。但是这种相互作用是如何发生的?为了将表征计算与认知系统的输入和输出端结合起来,需要发展一种两种回路之间的接口理论。
霍普菲尔德式观念本身可能隐藏了关于认知功能的更深层次的真相。大脑可以将亚细胞、神经元、小回路或大量群体组成部分的动态计算组合在一起来解决生态层面的挑战。因此,认知的第一级解释可能需要新的神经科学,它在从单个分子到整个大脑的许多时空尺度上构建状态空间。这种新颖的认知神经科学产生的动力学对象及其功能解释将成为认知的一级解释器。各种神经现象实现层面的细节将是二级解释器;也就是说,只解释普通的对象,而间接地解释认知现象。因此,如这里针对聚合神经群体数据所描述的一样,霍普菲尔德主义可能只是更广泛的方法之一。理论家可以使用这些方法构建新的动态对象以帮助理解认知。这对人工智能具有重要意义,因为虽然可以抽象出神经群体的特性,但其他组织特性在构建这些新的解释对象中也可能很重要。然后,理论家应建立一个广泛的表征和计算网络,从而利用大脑和行为各个层面的证据,得出关于思想本质的结论。
引用文献
Gallistel, C. R. & King, A. P. Memory and the Computational Brain: Why Cognitive Science Will Transform Neuroscience Vol. 3 (Wiley, 2009).
Goodman, N. Languages of Art: An Approach to a Theory of Symbols (Hackett Publishing, 1976).
Fodor, J. A. Propositional attitudes. Monist 61, 501–523 (1978).
Fodor, J. A. Psychosemantics: The Problem of Meaning in the Philosophy of Mind (MIT Press, 1987).
Fodor, J. A. A Theory of Content and Other Essays (MIT Press, 1990).
Cummins, R. Meaning and Mental Representation (MIT Press, 1989).
Cummins, R., Putnam, H. & Block, N. Representations, Targets, and Attitudes (MIT Press, 1996).
Millikan, R. G. Language, Thought, and Other Biological Categories: New Foundations for Realism (MIT Press, 1984).
Ramsey, W. M. Representation Reconsidered (Cambridge Univ. Press, 2007).
Shea, N. Representation in Cognitive Science (Oxford Univ. Press, 2018).
Yamins, D. L. & DiCarlo, J. J. Using goal- drivendeep learning models to understand sensory cortex. Nat. Neurosci. 19, 356 (2016).
Rajalingham, R. & DiCarlo, J. J. Reversible inactivation of different millimeter- scale regions of primate IT results in different patterns of core object recognition deficits. Neuron 102, 493–505 (2019).
DiCarlo, J. J., Zoccolan, D. & Rust, N. C. How does the brain solve visual object recognition? Neuron 73, 415–434 (2012).
Tsao, D. Y., Freiwald, W. A., Knutsen, T. A., Mandeville, J. B. & Tootell, R. B. H. Faces and objects in macaque cerebral cortex. Nat. Neurosci. 6, 989–995 (2003).
Bao, P., She, L., McGill, M. & Tsao, D. Y. A map of object space in primate inferotemporal cortex. Nature 583, 103–108 (2020).
Kriegeskorte, N. & Diedrichsen, J. Peeling the onion of brain representations. Annu. Rev. Neurosci. 42, 407–432 (2019).
Yuste, R. From the neuron doctrine to neural networks. Nat. Rev. Neurosci. 16, 487–497 (2015).
Eichenbaum, H. Barlow versus Hebb: when is it time to abandon the notion of feature detectors and adopt the cell assembly as the unit of cognition? Neurosci. Lett. 680, 88–93 (2018).
Sherrington, C. S. Observations on the scratch‐reflex in the spinal dog. J. Physiol. 34, 1–50 (1906).
Barlow, H. B. Summation and inhibition in the frog’s retina. J. Physiol. 119, 69–88 (1953).
Parker, D. Complexities and uncertainties of neuronal network function. Philos. Trans. R. Soc. B Biol. Sci. 361, 81–99 (2006).
Tye, K. M. & Uchida, N. Editorial overview: Neurobiology of behavior. Curr. Opin. Neurobiol. 49, iv–ix (2020).
Marder, E., Goeritz, M. L. & Otopalik, A. G. Robust circuit rhythms in small circuits arise from variable circuit components and mechanisms. Curr. Opin. Neurobiol. 31, 156–163 (2015).
Creutzfeldt, O. D. Generality of the functional structure of the neocortex. Naturwissenschaften 64, 507–517 (1977).
Douglas, R. J., Martin, K. A. & Whitteridge, D. A canonical microcircuit for neocortex. Neural Comput. 1, 480–488 (1989).
Harris, K. D. & Shepherd, G. M. The neocortical circuit: themes and variations. Nat. Neurosci. 18, 170–181 (2015).
Britten, K. H., Shadlen, M. N., Newsome, W. T. & Movshon, J. A. Responses of neurons in macaque MT to stochastic motion signals. Vis. Neurosci. 10, 1157–1169 (1993).
Salzman, C. D. & Newsome, W. T. Neural mechanisms for forming a perceptual decision. Science 264, 231–237 (1994).
Roitman, J. D. & Shadlen, M. N. Response of neurons in the lateral intraparietal area during a combined visual discrimination reaction time task. J. Neurosci. 22, 9475–9489 (2002).
Gold, J. I. & Shadlen, M. N. Banburismus and the brain: decoding the relationship between sensory stimuli, decisions, and reward. Neuron 36, 299–308 (2002).
Shadlen, M. & Newsome, W. Motion perception: seeing and deciding. Proc. Natl Acad. Sci. USA 93, 628–633 (1996).
Mazurek, M. E., Roitman, J. D., Ditterich, J. & Shadlen, M. N. A role for neural integrators in perceptual decision making. Cereb. Cortex 13, 1257–1269 (2003).
Ditterich, J. Stochastic models of decisions about motion direction: behavior and physiology. Neural Netw. 19, 981–1012 (2006).
Zeki, S. M. Cells responding to changing image size and disparity in the cortex of the rhesus monkey. J. Physiol. 242, 827–841 (1974).
Britten, K. H., Shadlen, M. N., Newsome, W. T. & Movshon, J. A. Responses of neurons in macaque MT to stochastic motion signals. Vis. Neurosci. 10, 1157–1169 (1993).
Britten, K. H., Shadlen, M. N., Newsome, W. T. & Movshon, J. A. The analysis of visual motion: a comparison of neuronal and psychophysical performance. J. Neurosci. 12, 4745–4765 (1992).
Blatt, G. J., Andersen, R. A. & Stoner, G. R. Visual receptive field organization and cortico- cortical connections of the lateral intraparietal area (area LIP) in the macaque. J. Comp. Neurol. 299, 421–445 (1990).
Latimer, K. W., Yates, J. L., Meister, M. L., Huk, A. C. & Pillow, J. W. Single- trial spike trains in parietal cortex reveal discrete steps during decision- making. Science 349, 184–187 (2015).
Katz, L. N., Yates, J. L., Pillow, J. W. & Huk, A. C. Dissociated functional significance of decision- related activity in the primate dorsal stream. Nature 535, 285–288 (2016).
Fusi, S., Miller, E. K. & Rigotti, M. Why neurons mix: high dimensionality for higher cognition. Curr. Opin. Neurobiol. 37, 66–74 (2016).
Rosenblatt, F. The perceptron: a probabilistic model for information storage and organization in the brain. Psychol. Rev. 65, 386 (1958).
Minsky, M. & Papert, S. A. Perceptrons: An Introduction to Computational Geometry (MIT Press, 1969).
Rigotti, M., Rubin, D. B., Wang, X. J. & Fusi, S. Internal representation of task rules by recurrent dynamics: the importance of the diversity of neural responses. Front. Comput. Neurosci. 4, 24 (2010).
Zador, A. M., Claiborne, B. J. & Brown, T. H. Nonlinear pattern separation in single hippocampal neurons with active dendritic membrane, in Advances in Neural Information Processing Systems 51–58 (NIPS, 1991).
Legenstein, R. & Maass, W. Branch- specific plasticity enables self- organization of nonlinear computation in single neurons. J. Neurosci. 31, 10787–10802 (2011).
Kimura, R. et al. Hippocampal polysynaptic computation. J. Neurosci. 31, 13168–13179 (2011).
Bianchi, D. et al. On the mechanisms underlying the depolarization block in the spiking dynamics of CA1 pyramidal neurons. J. Comput. Neurosci. 33, 207–225 (2012).
Gidon, A. et al. Dendritic action potentials and computation in human layer 2/3 cortical neurons. Science 367, 83–87 (2020).
Wang, X. J. Probabilistic decision making by slow reverberation in cortical circuits. Neuron 36, 955–968 (2002).
Hebb, D. The Organization of Behavior (Wiley, 1949).
McCrea, D. A. & Rybak, I. A. Organization of mammalian locomotor rhythm and pattern generation. Brain Res. Rev. 57, 134–146 (2008).
Fries, P. A mechanism for cognitive dynamics: neuronal communication through neuronal coherence. Trends Cognit. Sci. 9, 474–480 (2005).
Krakauer, J. W., Ghazanfar, A. A., Gomez- Marin, A., MacIver, M. A. & Poeppel, D. Neuroscience needs behavior: correcting a reductionist bias. Neuron 93, 480–490 (2017).
Jazayeri, M. & Afraz, A. Navigating the neural space in search of the neural code. Neuron 93, 1003–1014 (2017).
Paninski, L. & Cunningham, J. P. Neural data science: accelerating the experiment–analysis–theory cycle in large- scale neuroscience. Curr. Opin. Neurobiol. 50, 232–241 (2018).
Hu, Y., Trousdale, J., Josi
, K. & Shea- Brown, E. Motif statistics and spike correlations in neuronal networks. J. Stat. Mech. Theory Exp. 2013, P03012 (2013).
Hu, Y., Trousdale, J., Josi
, K. & Shea- Brown, E. Local paths to global coherence: cutting networks down to size. Phys. Rev. E 89, 032802 (2014).
Hu, Y. et al. Feedback through graph motifs relates structure and function in complex networks. Phys. Rev. E 98, 062312 (2018).
Recanatesi, S., Ocker, G. K., Buice, M. A. & Shea- Brown, E. Dimensionality in recurrent spiking networks: global trends in activity and local origins in connectivity. PLoS Comput. Biol. 15, e1006446 (2019).
Hopfield, J. J. Neural networks and physical systems with emergent collective computational abilities. Proc. Natl Acad. Sci. USA 79, 2554–2558 (1982).
Hopfield, J. J. Neurons with graded response have collective computational properties like those of two- state neurons. Proc. Natl Acad. Sci. USA 81, 3088–3092 (1984).
Hopfield, J. J. & Tank, D. W. Computing with neural circuits: a model. Science 233, 625–633 (1986).
Ramón y Cajal, S. Estudios sobre la corteza cerebral humana. Corteza visual. Rev. Trim. Microgr. 4, 1–63 (1899).
McCulloch, W. S. & Pitts, W. A logical calculus of the ideas immanent in nervous activity. Bull. Math. Biophys. 5, 115–133 (1943).
Buzsaki, G. Neural syntax: cell assemblies, synapsembles, and readers. Neuron 68, 362–385 (2010).
Saxena, S. & Cunningham, J. P. Towards the neural population doctrine. Curr. Opin. Neurobiol. 55, 103–111 (2019).
Mesulam, M.-M. From sensation to cognition. Brain J. Neurol. 121, 1013–1052 (1998).
Anderson, M. L. After Phrenology (Oxford Univ. Press, 2014).
Sporns, O. Networks of the Brain (MIT Press, 2010).
Lashley, K. S. Mass action in cerebral function. Science 73, 245–254 (1931).
Trautmann, E. M. et al. Accurate estimation of neural population dynamics without spike sorting. Neuron 103, 292–308 (2019).
Clark, A. A Theory of Sentience (Clarendon Press, 2000).
Gärdenfors, P. Conceptual Spaces: The Geometry of Thought (MIT Press, 2004).
Meister, M. L., Hennig, J. A. & Huk, A. C. Signal multiplexing and single- neuron computations in lateral intraparietal area during decision- making. J. Neurosci. 33, 2254–2267 (2013).
Mante, V., Sussillo, D., Shenoy, K. V. & Newsome, W. T. Context- dependent computation by recurrent dynamics in prefrontal cortex. Nature 503, 78–84 (2013).
Warden, M. R. & Miller, E. K. The representation of multiple objects in prefrontal neuronal delay activity. Cereb. Cortex 17, i41–i50 (2007).
Warden, M. R. & Miller, E. K. Task- dependent changes in short- term memory in the prefrontal cortex. J. Neurosci. 30, 15801–15810 (2010).
Rigotti, M. et al. The importance of mixed selectivity in complex cognitive tasks. Nature 497, 585–590 (2013).
Moser, E. I. et al. Grid cells and cortical representation. Nat. Rev. Neurosci. 15, 466 (2014).
Moser, E. I., Moser, M.-B. & McNaughton, B. L. Spatial representation in the hippocampal formation: a history. Nat. Neurosci. 20, 1448 (2017).
Fyhn, M., Molden, S., Witter, M. P., Moser, E. I. & Moser, M.-B. Spatial representation in the entorhinal cortex. Science 305, 1258–1264 (2004).
Hafting, T., Fyhn, M., Molden, S., Moser, M.-B. & Moser, E. I. Microstructure of a spatial map in the entorhinal cortex. Nature 436, 801–806 (2005).
Sargolini, F. et al. Conjunctive representation of position, direction, and velocity in entorhinal cortex. Science 312, 758–762 (2006).
Tolman, E. C. Cognitive maps in rats and men. Psychol. Rev. 55, 189 (1948).
Constantinescu, A. O., O’Reilly, J. X. & Behrens, T. E. Organizing conceptual knowledge in humans with a gridlike code. Science 352, 1464–1468 (2016).
Behrens, T. E. et al. What is a cognitive map? Organizing knowledge for flexible behavior. Neuron 100, 490–509 (2018).
Sorscher, B., Mel, G., Ganguli, S. & Ocko, S. A unified theory for the origin of grid cells through the lens of pattern formation, in Advances in Neural Information Processing Systems 10003–10013 (NeurIPS, 2019).
Cueva, C. J. & Wei, X.-X. Emergence of grid- like representations by training recurrent neural networks to perform spatial localization. Preprint at https:// arxiv.org/abs/1803.07770 (2018).
Banino, A. et al. Vector- based navigation using grid- like representations in artificial agents. Nature 557, 429–433 (2018).
Felleman, D. & Van Essen, D. Distributed hierarchical processing in the primate cerebral cortex. Cereb. Cortex 1, 1–47 (1991).
Zador, A. M. A critique of pure learning and what artificial neural networks can learn from animal brains. Nat. Commun. 10, 1–7 (2019).
Polger, T. W. & Shapiro, L. A. The Multiple Realization Book (Oxford Univ. Press, 2016).
Bechtel, W. A bridge between cognitive science and neuroscience: the functional architecture of mind. Philos. Stud. 44, 319–330 (1983).
Pylyshyn, Z. W. Computation and Cognition (Cambridge Univ. Press, 1984).
Ramon y Cajal, S. Estructura de los centros nerviosos de las aves Spanish.
Sherrington, C. The Integrative Action of the Central Nervous System (Archibald Constable, 1906).
Barlow, H. Single units and sensation: a neuron doctrine for perceptual psychology? Perception 1, 371–394 (1972).
Martin, K. A. A brief history of the “feature detector”. Cereb. Cortex 4, 1–7 (1994).
Shepherd, G. M. Foundations of the Neuron Doctrine (Oxford Univ. Press, 2015).
Kuhn, T. S. The Structure of Scientific Revolutions (Univ. of Chicago Press, 1962).
Haberkern, H. & Jayaraman, V. Studying small brains to understand the building blocks of cognition. Curr. Opin. Neurobiol. 37, 59–65 (2016).
Cobb, M. The Idea of the Brain: The Past and Future of Neuroscience (Basic Books, 2020).
Barack, D. L. Mental machines. Biol. Philos. 34, 63 (2019).
Fuster, J. The Prefrontal Cortex (Academic Press, 2008).
Arbib, M. A., Plangprasopchok, A., Bonaiuto, J. & Schuler, R. E. A neuroinformatics of brain modeling and its implementation in the Brain Operation Database BODB. Neuroinformatics 12, 5–26 (2014).
Carandini, M. & Heeger, D. J. Normalization as a canonical neural computation. Nat. Rev. Neurosci. 13, 51–62 (2012).
Wong, K.-F. & Wang, X.-J. A recurrent network mechanism of time integration in perceptual decisions. J. Neurosci. 26, 1314–1328 (2006).
Song, H. F., Yang, G. R. & Wang, X.-J. Reward- based training of recurrent neural networks for cognitive and value- based tasks. eLife 6, e21492 (2017).
Song, H. F., Yang, G. R. & Wang, X.-J. Training excitatory–inhibitory recurrent neural networks for cognitive tasks: a simple and flexible framework. PLoS Comput. Biol. 12, e1004792–e1004792 (2016).
Churchland, M. M., Byron, M. Y., Ryu, S. I., Santhanam, G. & Shenoy, K. V. Neural variability in premotor cortex provides a signature of motor preparation. J. Neurosci. 26, 3697–3712 (2006).
Churchland, M. M., Cunningham, J. P., Kaufman, M. T., Ryu, S. I. & Shenoy, K. V. Cortical preparatory activity: representation of movement or first cog in a dynamical machine? Neuron 68, 387–400 (2010).
Wong, A. L., Haith, A. M. & Krakauer, J. W. Motor planning. Neuroscientist 21, 385–398 (2015).
Haith, A. M. & Bestmann, S. in The Cognitive Neurosciences VI (eds Poeppel, D., Mangun, R., & Gazzaniga, M. S.) 541–548 (MIT Press, 2020).
Shenoy, K. V., Sahani, M. & Churchland, M. M. Cortical control of arm movements: a dynamical systems perspective. Annu. Rev. Neurosci. 36, 337–359 (2013).
Vyas, S., Golub, M. D., Sussillo, D. & Shenoy, K. Computation through neural population dynamics. Annu. Rev. Neurosci. 43, 249–275 (2020).
Yoo, S. B. M. & Hayden, B. Y. Economic choice as an untangling of options into actions. Neuron 99, 434–447 (2018).
Golub, M. D. et al. Learning by neural reassociation. Nat. Neurosci. 21, 607–616 (2018).
Wang, J., Narain, D., Hosseini, E. A. & Jazayeri, M. Flexible timing by temporal scaling of cortical responses. Nat. Neurosci. 21, 102–110 (2018).
Egger, S. W., Le, N. M. & Jazayeri, M. A neural circuit model for human sensorimotor timing. Nat. Commun. 11, 3933 (2020).
Remington, E. D., Egger, S. W., Narain, D., Wang, J. & Jazayeri, M. A dynamical systems perspective on flexible motor timing. Trends Cogn. Sci. 22, 938–952 (2018).
Sohn, H., Narain, D., Meirhaeghe, N. & Jazayeri, M. Bayesian computation through cortical latent dynamics. Neuron 103, 934–947 (2019).
Chaisangmongkon, W., Swaminathan, S. K., Freedman, D. J. & Wang, X.-J. Computing by robust transience: how the fronto- parietal network performs sequential, category- based decisions. Neuron 93, 1504–1517 (2017).
Sarafyazd, M. & Jazayeri, M. Hierarchical reasoning by neural circuits in the frontal cortex. Science 364, eaav8911 (2019).
Feynman, R. P. Space–time approach to quantum electrodynamics. Phys. Rev. 76, 769 (1949).
De Regt, H. W. Understanding Scientific Understanding (Oxford Univ. Press, 2017).
Bertolero, M. A. & Bassett, D. S. On the nature of explanations offered by network science: A perspective from and for practicing neuroscientists .Top. Cogn. Sci. 12, 1272–1293 (2020).
Kohn, A. et al. Principles of corticocortical communication: proposed schemes and design considerations. Trends Neurosci. 43, 725–737 (2020).
Nelson, S. B. Cortical microcircuits: diverse or canonical? Neuron 36, 19–27 (2002).
Churchland, P. M. Cognitive neurobiology: a computational hypothesis for laminar cortex. Biol. Philos. 1, 25–51 (1986).
Lisman, J. et al. The molecular basis of CaMKII function in synaptic and behavioural memory. Nat. Rev. Neurosci. 3, 175–190 (2002).
Janak, P. H. & Tye, K. M. From circuits to behaviour in the amygdala. Nature 517, 284–292 2015).
Churchland, M. M. et al. Stimulus onset quenches neural variability: a widespread cortical phenomenon. Nat. Neurosci. 13, 369–378 (2010).
Marr, D. Vision (Henry Holt, 1982).
Sterelny, K. The Representational Theory of Mind: An Introduction (Blackwell, 1990).
Shagrir, O. Marr on computational- level theories. Philos. Sci. 77, 477–500 (2010).
Haugeland, J. Artificial Intelligence: The Very Idea (MIT Press, 1985).